フラグメント解析のデータには、サンプルピーク以外のノイズピークが検出されることがあります。このようなノイズピークの発生は、解析に要する時間や労力が増えるだけでなく、解析結果の解釈にも影響を与える場合があります。本ブログでは、さまざまなノイズピークについて、予測される原因と対処法をご紹介します。
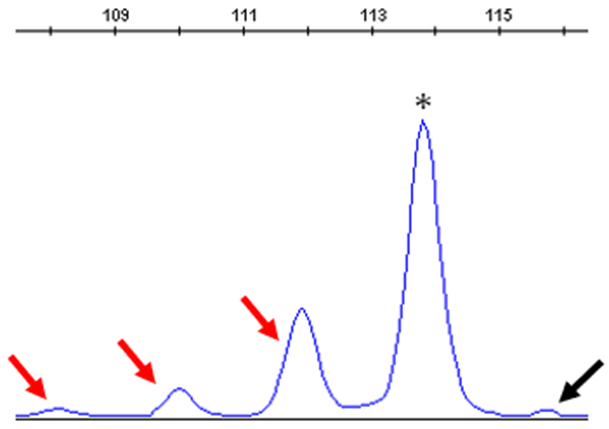
スタッターピーク
スタッターピークとは、繰り返し配列のPCR中に発生する産物由来のピークです。PCR反応中にDNAポリメラーゼのエラーにより、1つの繰り返し単位が欠失もしくは挿入され、結果として目的のピークに対して、欠失もしくは挿入された繰り返し単位分小さいもしくは大きいピークが発生します。主に1から4塩基の繰り返し単位をもつ配列で発生します。
| 予測される原因 | 対処法 |
| 繰り返し配列のPCRによりスタッターピークが発生している | スタッターピークとして、サンプルピークと区別する |
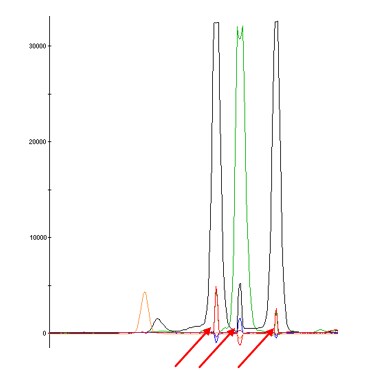
プルアップピーク
プルアップピークとは、ある蛍光波長を検出する際に漏れこんでくる隣接する蛍光波長のピークです。このような漏れこんできた蛍光波長のピークは、元となる蛍光波長のピークと近い位置に検出されます。プルアップピークが発生した時に予想される原因と対処法は以下の通りです。
| 予測される原因 | 対処法 |
| サンプル量が多過ぎる |
|
| スペクトラルキャリブレーションが適切に行われていない | 適切な試薬を用いてスペクトラルキャリブレーションを再度実施する |
| ポリマーが劣化している | Applied Biosystems™ 3500、Applied Biosystems™ SeqStudio™ Flexシリーズジェネティックアナライザ:
|
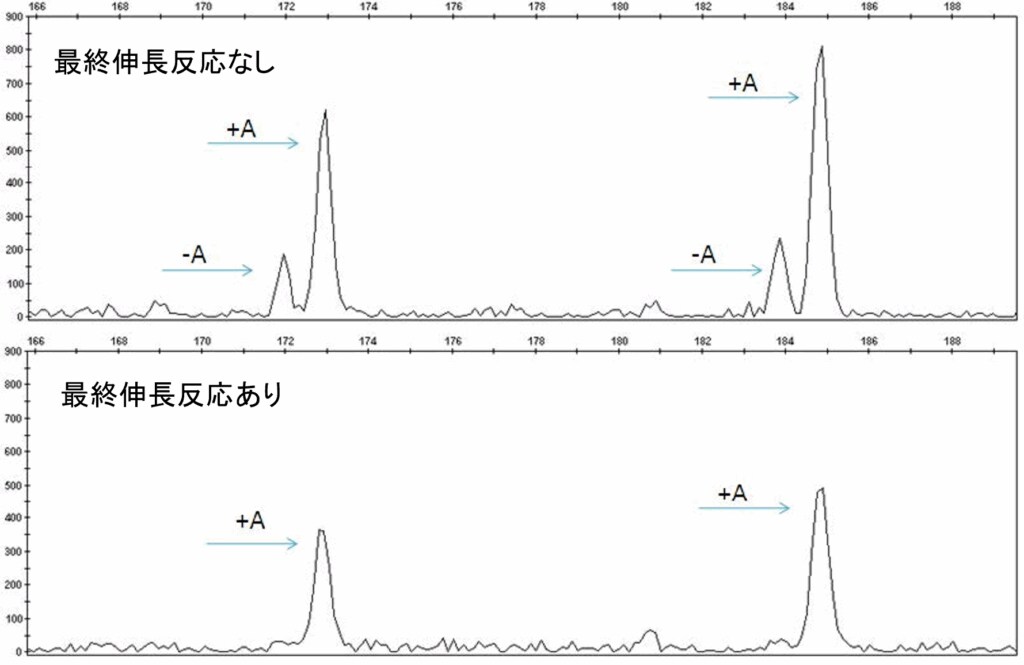
プラスAピーク(スプリットピーク)
PCRではDNAポリメラーゼによりPCR産物の3’末端に1ヌクレオチド(主にアデノシン)が付加される現象が発生します。鋳型の配列に依存して付加される割合は変わってきます。結果として実際のPCR産物よりも1ヌクレオチド分長いピークが発生し、プラスAピークと呼ばれます。本来1つのピークがスプリットピークとして2つ検出されるため、データの解析が複雑になります。
対処法の1つとして、PCRプロトコールに72℃ 60分間の最終伸長反応を追加することがあげられます(図3)。ほぼ全てのPCR産物にアデノシンが付加されるため、スプリットピークが解消されることがあります。
予測される原因と対処法は以下の通りです。
| 予測される原因 | 対処法 |
| PCR条件、プライマー設計が最適ではない |
以下のPCR条件の対処によりAの付加を増やす
|
| PCR時の鋳型DNA濃度が高い | PCR時の鋳型DNA量を減らす |
スパイクノイズ
通常のピークより幅が狭く、すべての蛍光波長において同じ位置に発生することもあります。一過性であることが多いですが、繰り返し発生する場合に予測される原因と対処法は以下の通りです。
| 予測される原因 | 対処法 |
以下が電気泳動中に検出
|
3500、SeqStudio Flexシリーズジェネティックアナライザ:
|
その他のノイズピーク
ノイズピークは実験条件や実験を行っている環境などさまざまな原因によっても発生します。ノイズピークが発生した時に予測される原因と対処法は以下の通りです。
| 予測される原因 | 対処法 |
| PCR産物が分解してしまっている | PCRを再度実施する |
| サンプルが適切に熱変性されていない | サンプルを95℃ 3分間加熱し、5分間氷冷後、電気泳動する |
| サンプルを熱変性した後に時間が経過している | サンプルを変性直後にランをするようにする |
不適切なプライマー設計により以下のような症状が発生している
|
プライマーの設計を見直す |
| 使用している試薬やサンプルにコンタミネーションが発生している |
|
まとめ
ノイズピークの特性を理解し、発生をできるだけ防ぐことは、適切な結果の解釈のためにとても重要です。さらに、これによりデータ解析の効率が向上し、時間と労力を節約できます。
キャピラリ電気泳動によるフラグメント解析について、より詳しく知りたい方は、こちらから、フラグメント解析の概要やアプリケーションを学べる資料をダウンロードいただけます。また、フラグメント解析の基礎セミナーやハンズオントレーニングもございますので、ぜひご活用ください。
フラグメント解析アプリケーションガイド
研究用にのみ使用できます。診断用には使用いただけません。