リン酸化は、生体内でシグナル伝達や細胞機能調節などの非常に重要な役割を担っています。そのため、多くの研究者がリン酸化タンパク質をLC-MSで解析されています。リン酸化タンパク質の網羅的な解析は「リン酸化プロテオミクス」と呼ばれています。
しかし、リン酸化プロテオミクスは、一般的なLC-MSのサンプル調製では困難と言われています。理由は主に下記の2つです。
- リン酸化ペプチドは非常に存在率が低く、全ペプチドの1%以下のため
- リン酸化ペプチドは親水性が高く、非リン酸化ペプチドと比べてイオン化効率が低いため
つまり、わずかしかなくイオン化しづらいリン酸化ペプチドを「いかに多く、いかに精製した状態で解析に持ち込むか」が鍵となります。
別のブログでは、タンパク質サンプルのLC-MS前処理において、おさえておきたい点をご紹介しました。しかし、リン酸化プロテオミクスのサンプル調製では、上述の理由から、このブログの内容に沿うだけでは解析できません。必ず、一工夫が必要です。
本ブログでは、リン酸化プロテオミクス向けのサンプル調製の「一工夫」をご紹介します。
▼もくじ [非表示]
LC-MSリン酸化サンプル前処理のポイント
では、リン酸化プロテオミクスを実施するには、LC-MS前のサンプル調製でどのような点に気をつければよいでしょうか。
下記3点は必ずおさえておきましょう。
1. タンパク質抽出ステップでは、ホスファターゼインヒビターを添加する
せっかく抽出してきても内在性のホスファターゼによって脱リン酸化されていては元も子もありません。リン酸化の解析の際は、細胞や組織を抽出するときに用いるLysis Bufferに、ホスファターゼ阻害剤、またはプロテアーゼ/ホスファターゼ阻害剤を必ず加えましょう。
2. クリーンアップ工程では、C18よりもグラファイトカラムまたはEasyPepシリーズがおすすめ
別のブログでもご紹介しているように、クリーンアップ工程ではC18逆相カラムがよく使用されます。しかし、リン酸化ペプチドは親水性が高いため、非リン酸化ペプチドよりもC18による保持力が下がり、C18逆相カラムでは回収率が落ちやすい傾向にあります。
そのため、リン酸化プロテオミクスの場合、クリーンアップ工程に使用するカラムは、C18よりもグラファイトカラムがおすすめです。
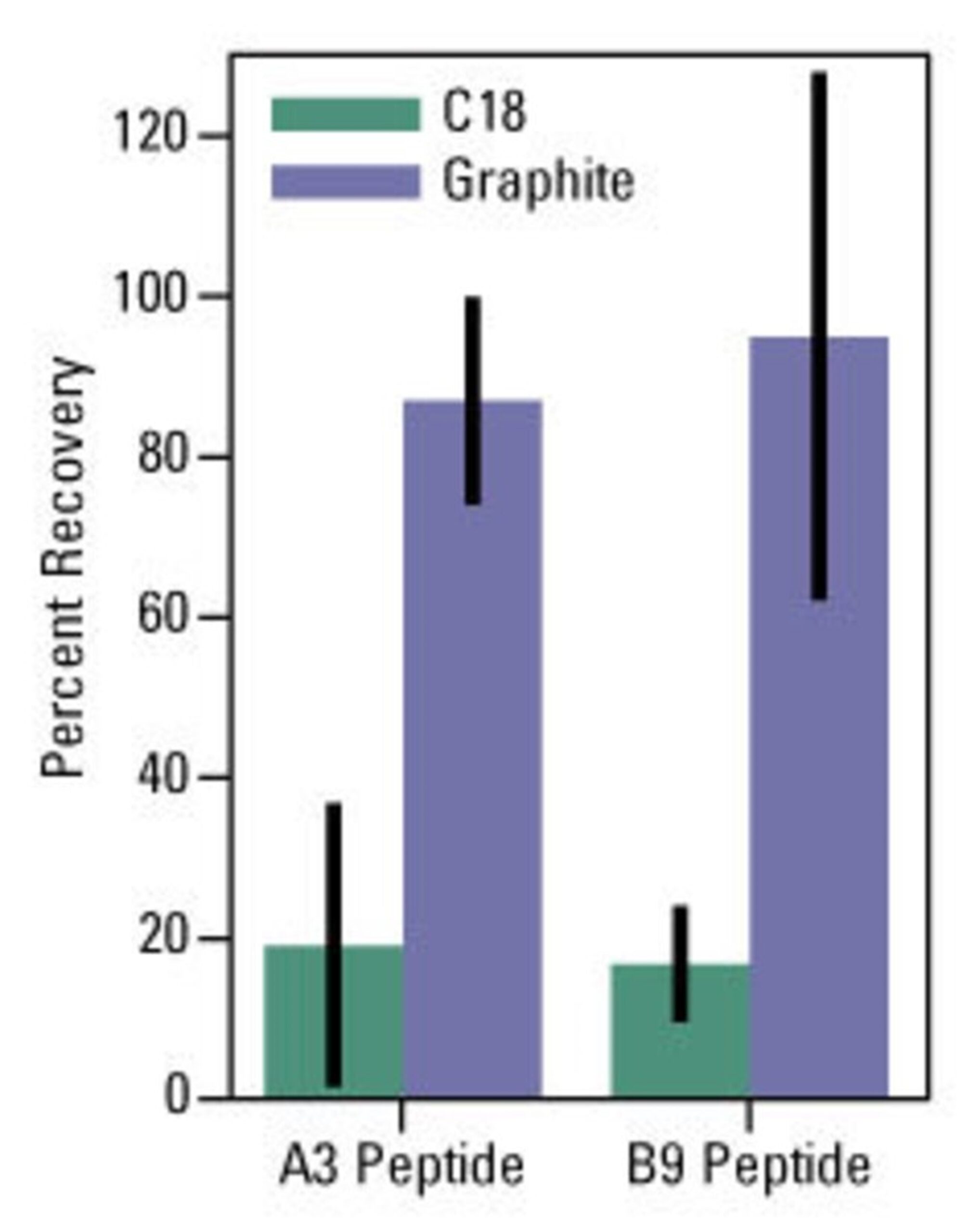
図1. グラファイトスピンカラムを用いたリン酸化ペプチドの回収
安定同位体で標識したA3およびB9ペプチド(10 pmol)を1%トリフルオロ酢酸で酸性化し、C18チップまたはThermo Scientific™ Pierce™ Graphite Spin Columnsのプロトコルに従って処理した後、50%アセトニトリル/0.1%ギ酸で溶出しました
所定の安定同位元素で標識したペプチド(5 pmol)を溶出液に添加し、乾燥した後、0.1%ギ酸に再懸濁しました
Thermo Scientific™ LTQ™ Orbitrap™ XL質量分析計を備えた標的化LC-MS/MSでサンプルを解析し、回収率を定量化しました
ペプチド:A3 = RPRAApTFPFR¹、B9 = RTPKDpSPGIPPFR※¹
※1 MSでの絶対量測定に用いた重同位体標識アミノ酸の位置
または、サンプル抽出からクリーンアップまで行えるThermo Scientific™ EasyPep™シリーズを用いましょう。EasyPepシリーズのカラムは、リン酸化ペプチドにも適応しているためです。EasyPepシリーズはLC-MS前のサンプル調製の所要時間を節約しつつ、再現性が向上できるように設計された製品で、これから質量分析を行う方におすすめのキットです。詳しくはこちらをご参照ください。
3. LC-MS前に濃縮を行う
リン酸化プロテオミクスの場合、濃縮ステップは非常に重要です。何しろ全タンパク質のうちリン酸化タンパク質は1%以下、そのわずかなものを解析するには、大多数の非リン酸化ペプチドが邪魔です。よって、できるかぎり非リン酸化ペプチドを除去し、リン酸化ペプチドだけに濃縮した状態でLC-MS解析を行うことが、同定数を向上させます。
濃縮は、クリーンアップ後、LC-MS直前に実施することをおすすめします。塩などが含まれていると、リン酸化ペプチド濃縮の目的で実施されるアフィニティクロマトグラフィーでの回収率に影響するためです。

濃縮には、リン酸基と金属のアフィニティを利用した方法が用いられます。主に利用されているのは、固定化金属アフィニティクロマトグラフィー (immobilized metal affinity chromatography:IMAC)と金属酸化物アフィニティクロマトグラフィー(metal oxide affinity chromatography:MOAC)の2種です。IMACではFeやGa、MOACではTiやZrなどが使われます。
では、IMACとMOAC、リン酸化ペプチドの濃縮には、どちらがより良いのでしょうか。
その答えを得るために、IMACとMOACを用いたリン酸化ペプチドの濃縮結果を比較してみましょう。
図2は、IMACを原理としたThermo Scientific™ High-Select™ Fe-NTA Phosphopeptide Enrichment Kit(以下Fe-NTA)と、MOACを原理としたThermo Scientific™ High-Select™ TiO2 Phosphopeptide Enrichment Kit(以下TiO2)を用いて濃縮し、質量分析で同定した結果です。
Fe-NTAでは8,912(3,983+4,929)、TiO2では9,293(4,364+4,929)のリン酸化ペプチドを同定できましたが、リン酸化ペプチドのオーバーラップは50%程度で、残り半分はFe-NTAとTiO2、いずれかの手法でのみ同定されたリン酸化ペプチドでした。
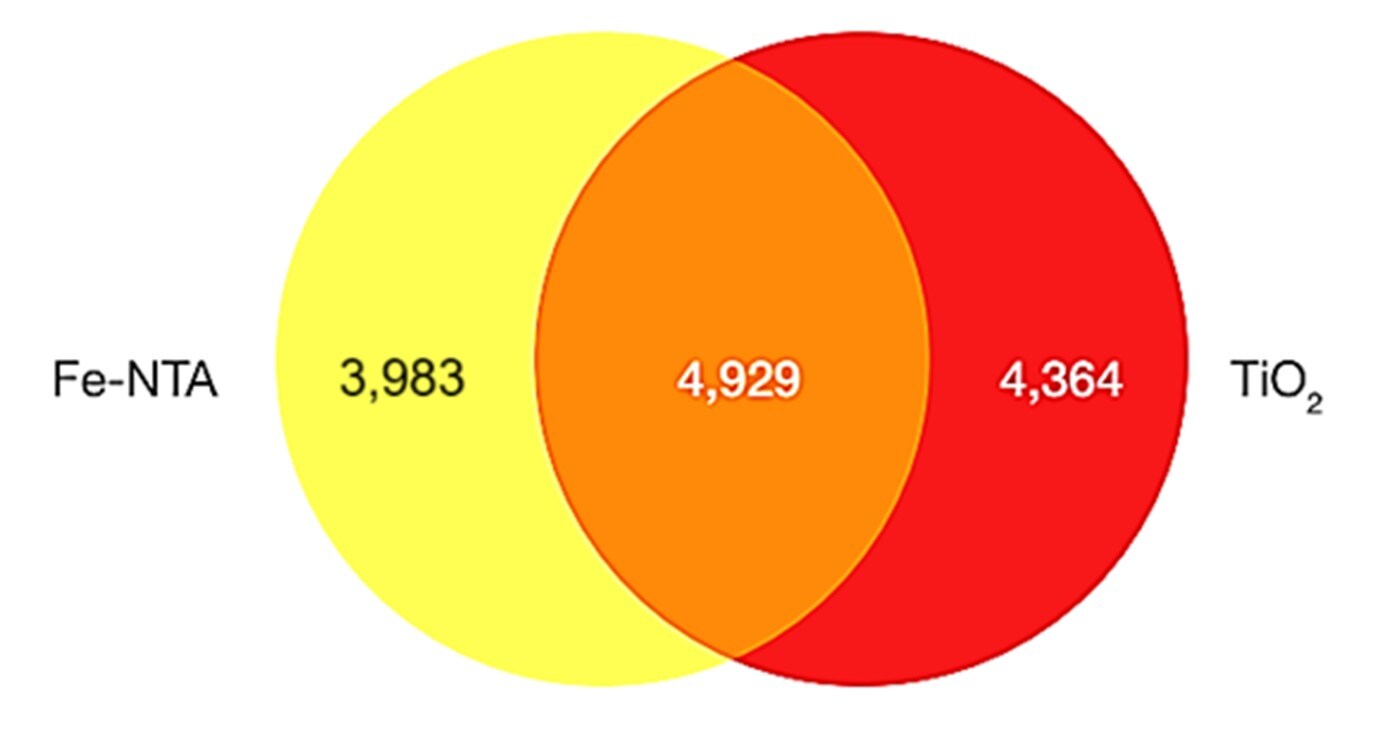
図2. Fe-NTA および TiO2 で濃縮後、同定されたリン酸化ペプチドの数
ノコダゾール処理した HeLa 細胞から調製したペプチド1.0 mgを用いました
溶出されたペプチドは、Thermo Scientific™ Orbitrap™ Fusion™ Tribrid質量分析計で、Trapカラムおよび Thermo Scientific™ Acclaim™ PepMap™ RSLC C18 (2 µm、100Å、75 µm x 50 cm) を使用して分析されました
さらに、Fe-NTAとTiO2それぞれで同定されたリン酸化ペプチドの傾向を解析したのが図3です。同定された全リン酸化ペプチドのうち、Fe-NTAでは1カ所でリン酸化されたペプチドが84%、2カ所でリン酸化されたペプチドが11%を占めていました。一方、TiO2では、1カ所でリン酸化されたペプチドが72%、2カ所でリン酸化されたペプチドが20%を占めていました。
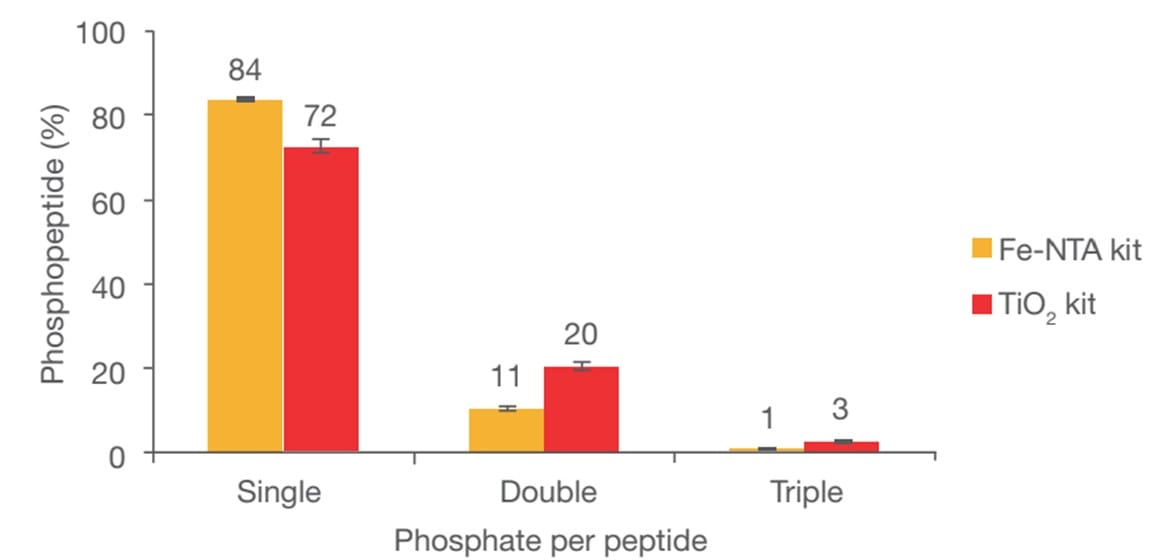
図3. Fe-NTA、TiO2で濃縮後、リン酸基数のプロファイルを実施した結果
使用サンプル、使用機器は図2と同様です
参考リンク:LC-MS前処理のペプチドエンリッチメントと分画
つまり、図2の結果から、それぞれの手法で同定されるリン酸化ペプチドは50%しかオーバーラップしないことがわかり、図3の結果から、Fe-NTAはモノリン酸化、TiO2は多重リン酸化をより濃縮しやすい傾向にあることがわかります。
では、最初の疑問に戻ります。より包括的なリン酸化プロテオミクスを目指すためには、どちらがより良いのでしょうか。しかし、この疑問にはまだ答えられません。モノリン酸化と多重リン酸化、いずれの解析もしたい場合、Fe-NTAとTiO2は一長一短で選べないからです。
ならば、Fe-NTAとTiO2どちらか一方のみを用いるのではなく、2つの手法を組み合わせれば、同定数は果たして増えるのでしょうか?
リン酸化ペプチド濃縮に最適な方法は?
より包括的なリン酸化プロテオミクスのために最適な濃縮方法を探すため、さらなる実験を行いました。Fe-NTAとTiO2を組み合わせる手法の検討です。
Fe-NTAとTiO2の両方を実施する場合、選択肢は2つ存在します。
- SIMAC(Sequential elution from IMAC):Fe-NTA→TiO2の順に濃縮
- SMOAC(Sequential elution from MOAC):TiO2→Fe-NTAの順に濃縮
この2つの濃縮方法を試し、リン酸化ペプチドの同定数を比較しました。
まず、実験の流れを示したのが図4です。
図4AのSIMACでは、Fe-NTAで濃縮・溶出した画分をFraction1とし、続けてフロースルー画分をTiO2にて濃縮・溶出しました(Fraction2)。
図4BのSMOACではTiO2で濃縮・溶出した画分をFraction3とし、続けてフロースルー画分をFe-NTAで濃縮・溶出しました(Fraction4)。
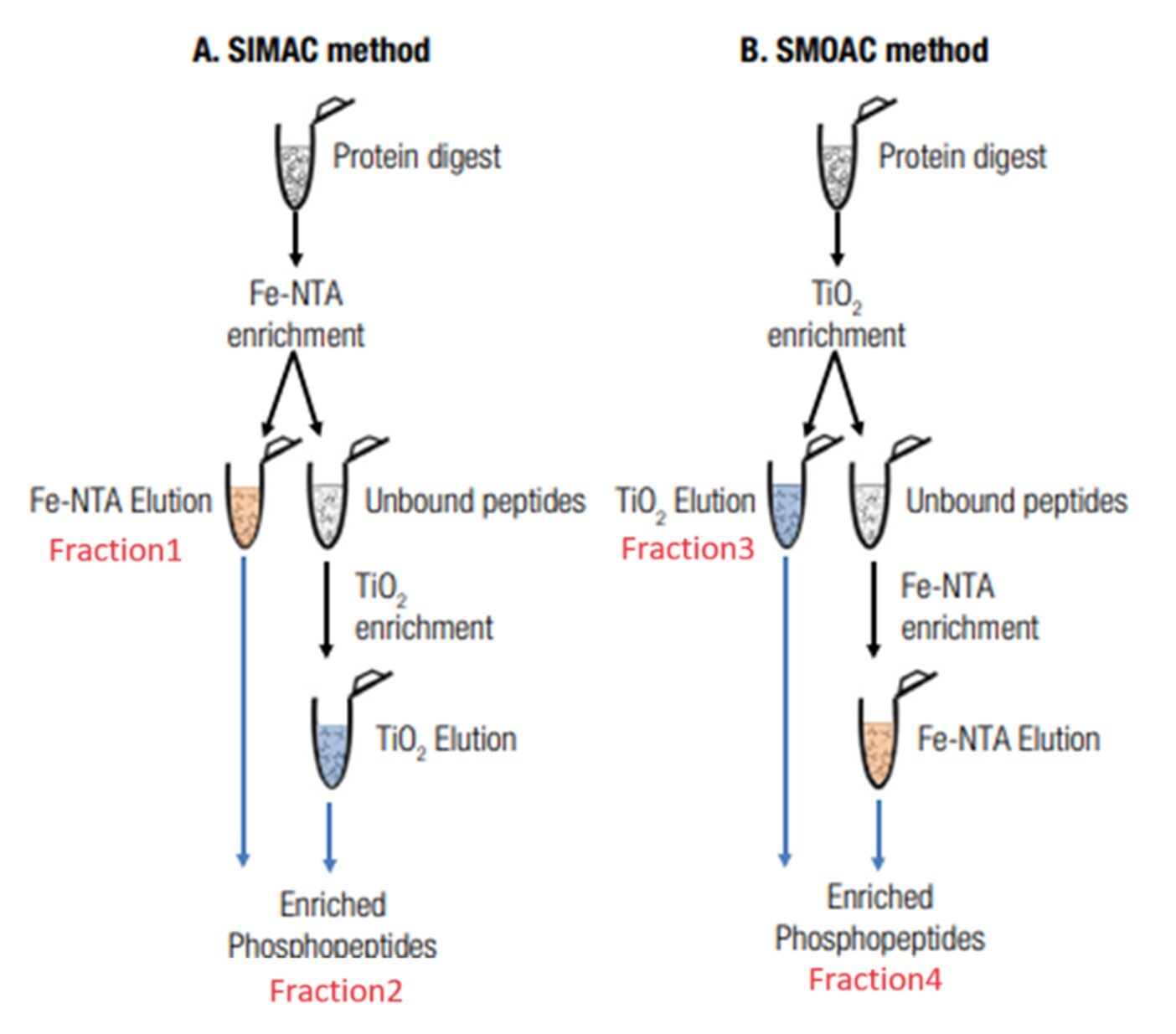
図4. A) SIMACとB) SMOACを利用した連続濃縮フロー
図4の各フラクションを用いてLC-MSでリン酸化ペプチドの解析を行った結果が、図5です。
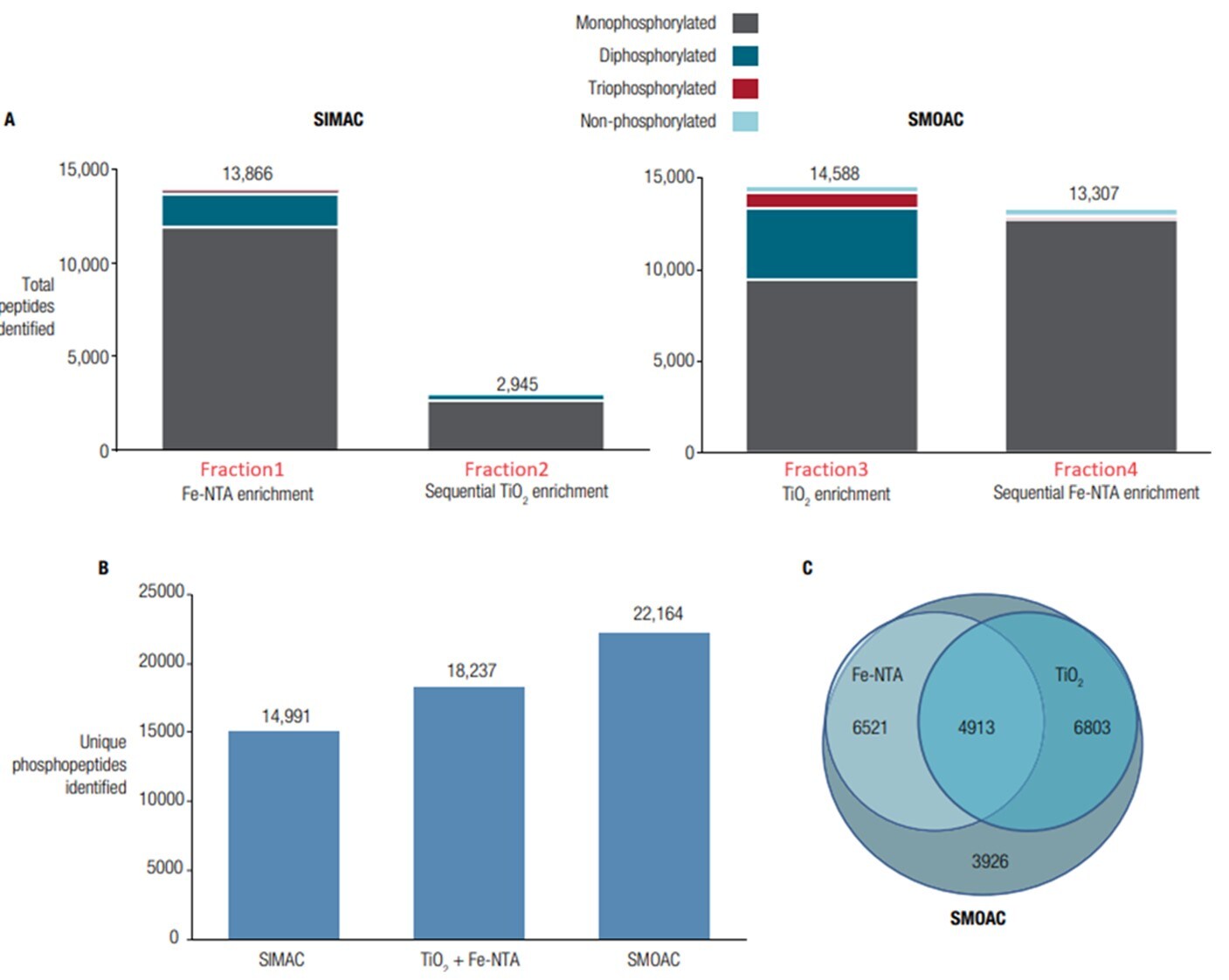
図5. リン酸化ペプチド濃縮における SIMAC と SMOAC の評価
ノコダゾール処理した HeLa トリプシン消化物 1 mg を使用して、リン酸化ペプチド濃縮に SIMAC と SMOAC の両方を評価しました
A)SIMACおよびSMOACを使用した連続濃縮後に同定されたペプチドの総数
B) SIMAC、各キットを個別に用いて濃縮した場合、SMOAC、それぞれにおいて同定されたリン酸化ペプチド数
C) リン酸化ペプチド同定の重複を示すベン図
使用キット: High-Select Fe-NTA Phosphopeptide Enrichment KitおよびHigh-Select TiO2 Phosphopeptide Enrichment Kit
※画像をクリックすると拡大表示できます
図5Aのとおり、SIMACの最初のステップFe-NTAによる濃縮(Fraction1)では13,866のリン酸化ペプチドを同定できたものの、続くTiO2での濃縮(Fraction2)では、同定数は2,945にとどまりました。
一方、SMOACの最初のステップTiO2による濃縮(Fraction3)では14,588と、Fraction1と大差ない結果となりましたが、続くFe-NTAでの濃縮(Fraction4)では13,307の同定に成功し、Fraction2の4倍程度の数が同定できました。
図5Bは、SIMAC、TiO2+Fe-NTAそれぞれで濃縮した場合、SMOACで同定されたリン酸化ペプチドのトータル数を比較したものです。SMOAC(同定数22,146)では、SIMAC(同定数14,991)やTiO2+ Fe-NTA(同定数18,237)よりも、多くのリン酸化ペプチドが同定されたことがわかりました。さらに、図5Cのとおり、SMOACで同定されたリン酸化ペプチドは、Fe-NTAおよびTiO2を単独で用いた場合に同定されたペプチドを網羅し、かつ、それ以上の数の同定に成功しています。
以上の結果より、High-Select Fe-NTA Phosphopeptide Enrichment Kit単独、およびHigh-Select TiO2 Phosphopeptide Enrichment Kit単独、さらにSIMACよりも、TiO2、Fe-NTAの順で連続して濃縮するSMOACが、最もリン酸化ペプチド同定数が多く、おすすめの方法であることがわかりました。
SMOACの具体的なプロトコルは、こちらからご覧いただけます。
まとめ
リン酸化ペプチドの存在比は低く、非リン酸化ペプチドに比べてイオン化もしづらいという点から、リン酸化プロテオミクスではサンプル調製時の一工夫が必須です。
ホスファターゼ阻害剤の添加、グラファイトカラムやEasyPepシリーズでのクリーンアップに加え、より多くのリン酸化ペプチド同定を目指すためにSMOACもぜひお試しください。
質量分析前処理ハンドブック~プロテオーム解析に必須な試薬やツール
このブログを読んだ人はこんなブログも読んでいます:
プロテオーム解析のサンプル調製、おさえておきたいポイント
界面活性剤を用いたタンパク質抽出|知っておきたい!タンパク質実験あれこれ 第1回
研究用にのみ使用できます。診断用には使用いただけません。