▼もくじ
はじめに
前回は粗精製程度の方法(Crudeレベルの精製)と抗体クラス(またはアイソタイプ)のレベルで精製する方法(抗体クラスレベルの精製)について紹介しました。今回は、目的抗原に特異的な抗体精製を行う方法(Specificな精製)について紹介します。
[ss url=”https://www.thermofisher.com/blog/learning-at-the-bench/protein-basic12/” width=”180″ class=”alignleft” alt=”知っておきたい!タンパク質実験あれこれ 第12回” rel=”nofollow” ext=0 title=”知っておきたい!タンパク質実験あれこれ 第12回 さまざまな抗体精製法をまとめてみた その1″ caption=”抗体の精製方法には、大きく分けて、Crudeレベルの精製、抗体クラスレベルの精製、Specificな精製の3つがあります。今回はそれぞれのレベルごとに精製方法を挙げてその概要をご紹介します!”]
Specificな精製
目的抗原に対する抗体以外の免疫グロブリンを除去して、できるだけ特異的な抗体のみを精製したい場合には、抗原を固定化した担体(支持体)を用いる方法が一般的です。この方法での精製を効率よく行うためには、目的抗原のエピトープと抗体との結合が阻害されないように抗原を担体に固定化する必要があります。特に抗原の分子量が小さい場合は、抗原を担体に直接化学的に結合させるとエピトープがブロックされてしまうことや、立体障害により抗体がエピトープにアクセスできなくなることがあるため、特定の官能基(アミノ基やスルフヒドリル基など)と反応する反応基(NHSエステルやヨードアセチル基など)が、ある程度のスペーサーアームを持った形で固定化している担体を利用します。抗原をキャリアタンパク質に架橋して抗体産生を行った場合は、通常、その架橋反応と同じ官能基と反応基を利用することで、エピトープのブロックを防ぐことができます。
抗原と抗体とのアフィニティーは、生理的条件下において高いため、通常、結合バッファーには0.15M NaClを含むpH 7.2程度のPBSやTBSが使用されます。またこのバッファーに更に塩や界面活性剤を添加し、非特異的な結合を除去するための洗浄バッファーとして利用されます。この高いアフィニティー結合を解離させて目的抗体を精製するためには、生理的条件から外れた条件で処理(溶出)する必要があり、通常、pH が2.5-3.0のグリシンが利用されます。一般的に抗体はpHが2.5~11.5の範囲では失活が起こりにくいとされていますが、変性や凝集を避けるために溶出直後に適当なバッファーにより中和してpHを生理的条件下に調整する必要があります。以下、抗原固定化用担体の代表例を紹介します。
抗原のアミノ基(-NH2基)を利用した固定
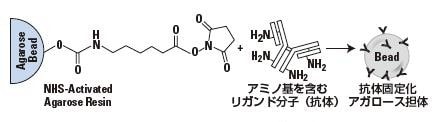
NHSエステル活性化アガロース
Pierce™ NHS-Activated Agarose Slurryは、N-hydro xysuccinimide (NHS) エステル基を末端に持つ6%架橋アガロース担体です。NHSエステル基はタンパク質やその他のリガンド分子に存在するアミノ基と反応して安定なアミド結合を形成します。
アルデヒド活性化アガロース
AminoLink™ Coupling Resinは、アルデヒド基を持つ4%架橋アガロース担体です。タンパク質やその他のリガンド分子に存在するアミノ基と反応します。アルデヒド基とアミノ基との結合は不安定なため、温和な還元剤で処理することにより安定な二級アミン結合を生成させます。
抗原のスルフヒドリル基(-SH基)を利用した固定
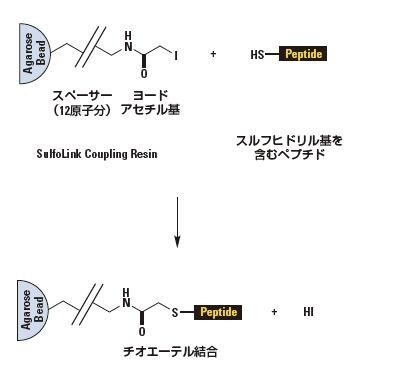
ヨードアセチル基活性化アガロース
SulfoLink™ Coupling Resinは、ヨードアセチル基を末端に持つ4%架橋アガロース担体です。還元システイン残基を含むタンパク質やその他のリガンド分子と反応し、非可逆的なチオエーテル結合を形成します。
抗原のカルボキシル基(-COOH基)を利用した固定
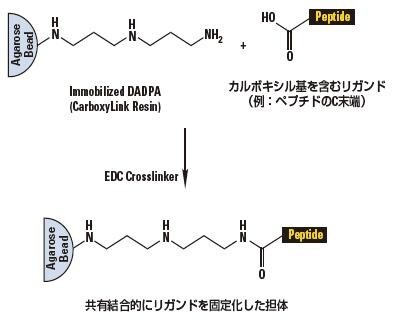
DADPA活性化アガロース
CarboxyLink™ Coupling Resinは、ジアミノジプロピルアミン(DADPA)で活性かされた4%架橋アガロース担体です。長いスペーサーアームの末端にアミノ基を持ち、1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC、EDACとも言う)と共に、カルボキシル基を含む分子を反応させると安定なアミド結合を形成します。
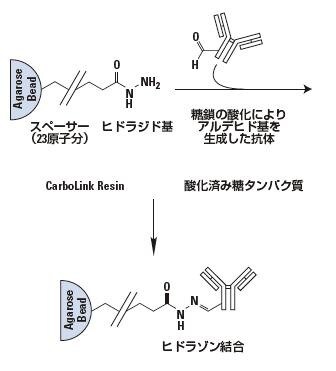
ヒドラジド活性化アガロース
CarboxyLink™ Coupling Resinは、ヒドラジドで活性化された6%架橋アガロース担体です。糖タンパク質や抗体の糖鎖に存在するシス-ジオール基(cis-diol基)を酸化して生じるアルデヒド基(-CHO基)とヒドラジド基との反応により、安定なヒドラゾン結合を形成します。
最後に
いかがでしょうか?
前回と今回で抗体精製のさまざまな方法を紹介しました。実際にはご紹介した方法以外にも、一般的なタンパク質精製に使用されるゲルろ過やイオン交換なども使用されることがあり、さまざまな手法を組合せて段階的に、より純度の高い抗体精製が行われます。次回は、前回で紹介した各抗体結合タンパク質(Protein A, Protein G, Protein A/G, Protein L)についてご紹介します!
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
共免疫沈降法関連、その他の記事はこちら
研究用にのみ使用できます。診断用には使用いただけません。
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。