細胞培養実験において、細胞数や生細胞率・死細胞率の測定(いわゆるセルカウント)は重要なステップです。これらの測定が不正確だと、実験が失敗したり再現性が損なわれたりする恐れがあります。接着性の培養細胞をセルカウントする場合、Trypsin-EDTAなどの細胞解離試薬で培養容器から細胞を剥がし、細胞懸濁液を調製します。適切な条件で剥がせていれば、多くの培養細胞は一つ一つの細胞がバラバラな状態になります。一方、ヒト肝臓癌由来の細胞株であるHep G2など、細胞同士が接着したままの状態になりやすいことが知られている細胞もあります。セルカウントの際に凝集している細胞が目立つ場合、皆さんはどのようにカウントしていますか?
- 見分けられる範囲でできるだけカウントする
- 凝集一つを細胞一つとしてカウントする
- 凝集はカウントしない(無視する)
いろいろなやり方が考えられますが、どの方法でも実際の細胞数よりも少なく見積もってしまうリスクがあります。そこで今回は、培養容器から剥がしたHep G2をバラバラにほぐせないかをあの手この手を使って検討してみました。結果として完全にバラバラにはできませんでしたが、皆さんの今後のセルカウントのヒントになれば幸いです。
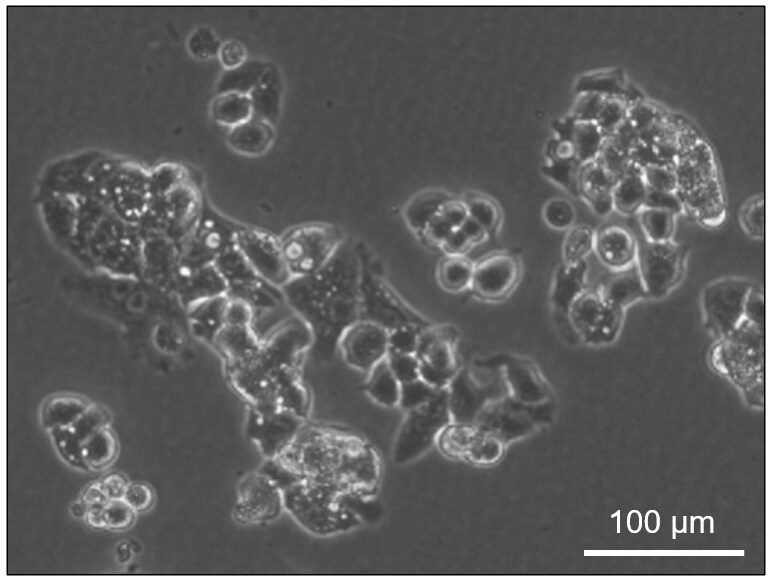
図1. Hep G2は凝集しやすい細胞として知られている
(写真はディッシュに張り付いているHep G2)
▼こんな方におすすめです!
- セルカウントでお困りの方
- 接着細胞の剥がし方でお困りの方
- 自動セルカウントに興味のある方
実験方法
■基本手順
- Hep G2を60 mmのThermo Scientific™ Nunc™ EasYDish™ Cell Culture Dish(製品番号 150462)で培養
- Gibco™ DPBS, no calcium, no magnesium(製品番号 14190144)を4 mL添加して洗浄
- Gibco™ TrypLE™ Select Enzyme (1X)(製品番号 12563011)を2 mL添加
- CO2インキュベーターで処理(37 ℃、10分間)
- 2 mLの血清入りGibco™ DMEM(製品番号 11995065)を添加して反応停止
- 15 mLの遠心チューブ(製品番号 339650)に回収し、200 ×gで3分間遠心
- 上澄みを除去し、1 mLの血清入りDMEMで再懸濁
- 細胞懸濁液とGibco™ Trypan Blue Solution(製品番号 15250061)を1:1で混合
- 混合液をInvitrogen™ Countess™ Cell Counting Chamber Slide(製品番号 C10283)に注入
- Invitrogen™ Countess™ 3 FL 自動セルカウンター(製品番号 AMQAF2000)の明視野モードで細胞濃度、生細胞率、死細胞率、凝集率を測定
今回は、細胞解離試薬としてTrypLE Select Enzymeを使いました。Trypsinと同様の酵素活性を持つ組み換え酵素TrypLE EnzymeとEDTAが含まれる試薬で、Trypsin-EDTAの代わりに使うことができます。詳しくは関連記事「シングルセル解析や初代培養に使われる細胞解離試薬の選択ガイド」を参照してください。
また、セルカウントではCountess 3 FL自動セルカウンターの明視野モードを使って、細胞濃度、生細胞率、死細胞率、凝集率を測定しました。標準的なプロトコルでHep G2を剥がすと多くの凝集が見られました。Countess 3 FL自動セルカウンターでは、図2のように凝集している細胞集団を識別して黄色の円でマークしてその比率を表示します。この例では、全体の47%の細胞が凝集した集団に含まれています。なお、凝集率は凝集に含まれている細胞数を全細胞数で割った比率です。今回の検討では、この凝集率を下げていくことが目標です。
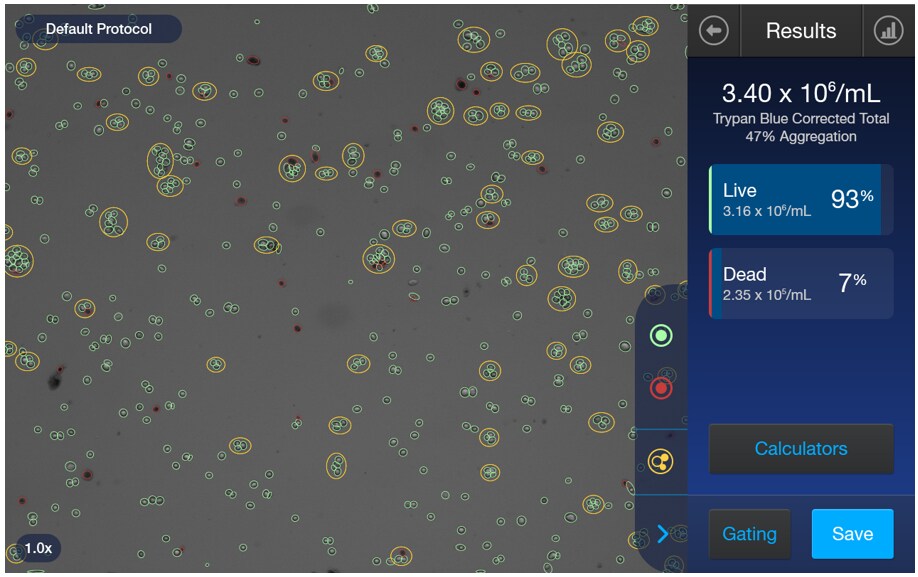
図2. Countess 3 FL自動セルカウンターは細胞濃度、生/死細胞率、凝集率を測定できる
たくさんピペッティングしてみた
細胞懸濁液に含まれる凝集をほぐす方法としてもっともシンプルなのは、ピペッティングの回数を増やすことです。そこで、1 mLのHep G2細胞懸濁液を1,000 µLのピペットチップで5回、10回、30回、50回ピペッティングしてみました。その結果を図3に示します。5回よりも10回ピペッティングすることで凝集率が低下しましたが、それ以上いくらピペッティングしても凝集率は低下しませんでした。なお、この時のHep G2の生細胞率はそれぞれのピペッティング回数で92.8%、90.3%、91.3%、90.5%で、統計的な有意差はありませんでした。ピペッティングの回数が生細胞率にほぼ影響しない結果はHeLaで行った以前の検証結果(関連記事「【やってみた】細胞を100回ピペッティングしてみた」)でも同様でした。
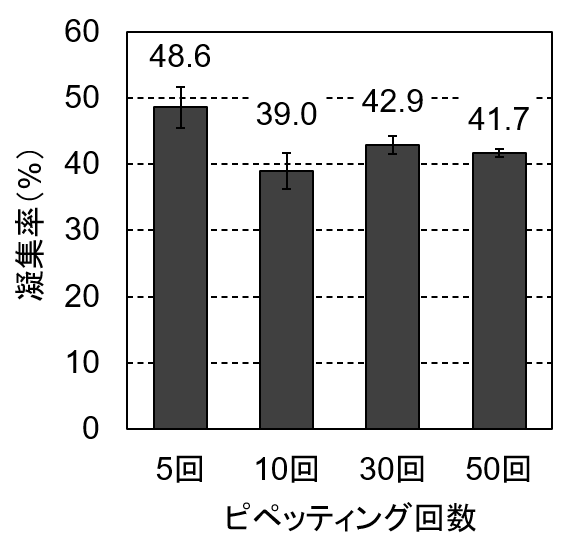
図3. たくさんピペッティングしてもHep G2はほぐれない
セルストレーナーを通してみた
細胞懸濁液から凝集物や大きな異物を取り除く消耗品としてセルストレーナーという製品があります。数10 µm程度の穴が開いているメッシュを遠心チューブにセットし、メッシュを通した細胞懸濁液をチューブに回収することができます。そこで今回はポアサイズ40 µmのセルストレーナーの効果を確認しました。その結果、凝集率を2/3に低下させることができましたが、凝集を完全に除くことはできませんでした(図4)。なお、今回はFisherbrand™セルストレーナー(製品番号 22-363-547)を使用しました。ラインアップの中ではポアサイズが一番小さい製品です。
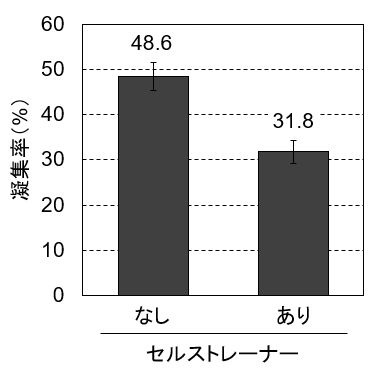
図4. セルストレーナーを通すこことで凝集した細胞の一部を除ける
Countess 3 FL 自動セルカウンターは、セルカウントと同時に細胞のサイズも計測しています。データをPDF形式のレポートで出力すると、平均サイズやサイズ分布のヒストグラムを確認することができます(図5)。
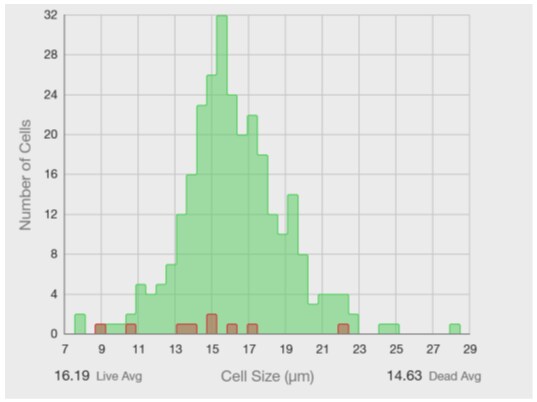
図5. Countess 3 FL自動セルカウンターは細胞サイズの分布をヒストグラム表示できる
Countess 3 FL自動セルカウンターから出力されるヒストグラムの左下と右下に、生細胞と死細胞のそれぞれの平均サイズが表示されます。ヒストグラムから、浮遊状態のHep G2のほとんどは10~20 µm程のサイズであることがわかります。今回使用したセルストレーナーのポアサイズは40 µmなので、2~数個の細胞でできた凝集はメッシュを通過してもおかしくありません。その結果して、セルストレーナーでは凝集を除ききれなかったと考えられました。
細胞解離試薬で長く処理してみた
ここまでの結果から、細胞懸濁液を物理的に後処理して凝集率を下げるのは難しいことがわかりました。そこで、細胞解離試薬での処理時間を延長して分散作用を強めてみることにしました。具体的には、TrypLE Select Enzymeでの処理時間を10分から20分、30分に延長して比較しました。なお、以降の実験では、回収した細胞懸濁液はセルストレーナーを通してからセルカウントしました。
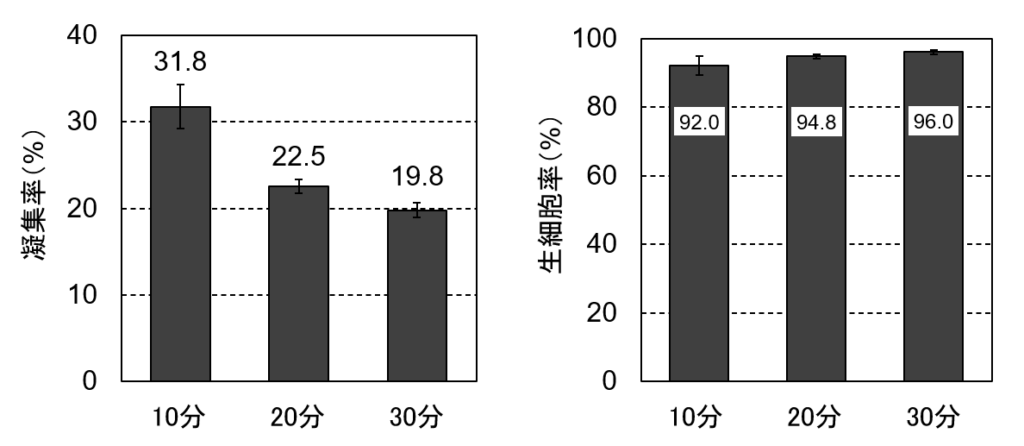
図6. TrypLE Select Enzymeによる処理時間を延ばすと凝集率が低下する
その結果、TrypLE Select Enzymeによる処理を30分間まで延長することで、凝集率を当初の半分以下にまで下げることができました(図6左)。また、このときに心配される生細胞率は影響を受けていないことが確認できました(図6右)。これら結果から、細胞の凝集率を下げるには解離酵素処理の条件を強めることが有効であることがわかりました。しかしながら、30分処理しても完全には分散させられず、日常的には10分以下の処理で継代されているであろうHep G2の解離操作にこれ以上の時間をかけるのは現実的ではありませんし、細胞へのダメージも懸念されます。
もっと強い細胞解離試薬で長く処理してみた
そこで今度はTrypLE Select Enzymeの10倍濃縮版(製品番号 A1217701)を使うことにしました。こちらを使えば、処理時間を延長せずに酵素処理を強めることができます。TrypLE Select Enzymeの通常版(1X)で30分間、10倍濃縮版(10X)で10分間と30分間で処理して細胞懸濁液を回収し、セルカウントしました。
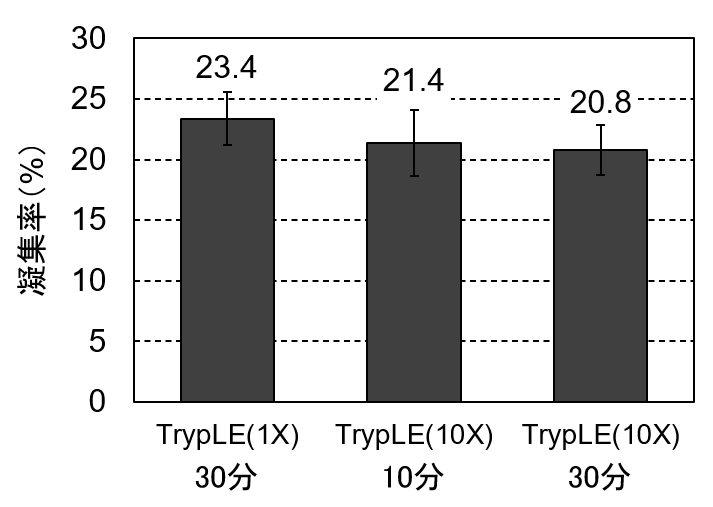
図7. TrypLE Select Enzyme処理を強めても凝集率の低減効果は小さい
その結果、10倍濃縮版のTrypLE Select Enzymeを使用しても、凝集率を顕著に下げることはできませんでした。Hep G2の凝集のしやすさには、TrypLE Enzymeの酵素活性では解決できない要因がありそうです。なお、この時の生細胞率はどの条件でも90%以上で有意差はありませんでしたが、その細胞を培養してみると10倍濃縮版のTrypLE Select Enzymeで処理した細胞の増殖率がわずかに低下していました。解離直後の生細胞率に問題がなくとも、その後の増殖に悪影響が起こりうることは念頭においてください。なお、HeLaで行った以前の検証でも類似の結果が得られていました(関連記事「【やってみた】”やさしい”細胞解離試薬「TrypLE」で細胞をきびしく処理してみた」)。
まとめ
今回は、凝集しやすい性質があるHep G2を用いて、凝集をほぐすためにあの手この手を試してみました。完全にほぐすことはできませんでしたが、
- ピペッティングをすればするほどほぐれるわけではない
- セルストレーナーは多少の効果がある
- 解離酵素処理の延長は効果があるが、完全ではない
などの結果を得られました。
Hep G2のように完全に分散させることが難しい細胞をセルカウントする場合は、細胞がダメージを受けない程度にしっかりと解離酵素を効かせてできるだけ分散させ、凝集に含まれる細胞もできるだけカウントした方が実際の濃度に近い結果が得られると考えられます。今回の検証で使用したCountess 3 FL自動セルカウンターは、凝集しやすい細胞のセルカウントにもある程度対応できます(図8)。ただし、画像解析でカウントしている仕組みですので、人間の目で見ても見分けられないような大きな凝集のカウントには対応できません。自分の判定と一致しているかどうかを、測定画面を見て確認しながら上手に活用してください。日常のセルカウントが負担に感じている方や正確性に不安がある方は、ぜひテクニカルサポート(jptech@thermofisher.com)へご相談ください。
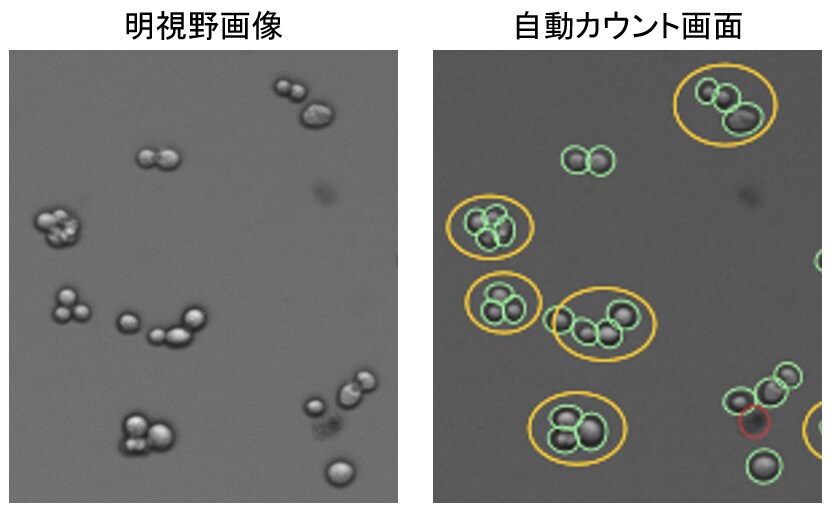
図8. Countess 3 FL自動セルカウンターはセルカウントの負担を軽減する
セルカウントについてもっと知りたい方は無料のオンラインセミナー「いまさら聞けない!細胞カウントを基本から学ぼう」や講義と実習で細胞培養の基本を習得できる細胞培養ハンズオントレーニング(1日コース、2日間コース)の受講をご検討ください。これらのトレーニングで学べる内容の違いについては関連記事「細胞培養関連の学習リソースまとめ~トレーニング・セミナー・ハンドブックなど~」で整理されています。セルカウントに限らず、細胞培養関連の試薬・アプリケーションなどでご不明点がありましたらテクニカルサポート(jptech@thermofisher.com)へお気軽にお問い合わせください。
Gibco細胞培養ハンドブックダウンロード(2021年リニューアル版)
研究用にのみ使用できます。診断用には使用いただけません。