ライゲーションがうまくいかなくてお困りでしょうか?そんなときはこちらの方法でT4 DNAリガーゼの活性を確認してみてください!
概要
SDS含有のローディングダイ(SDSの最終濃度は0.2%)と混合し、通常のアガロースゲル電気泳動に流すだけで、ライゲーション反応の効率を確認できます。ライゲーション反応後にいくつかの高分子のバンドが現れるはずです。ローディングダイにSDSが含まれていないと、スメアバンドが出現し、リガーゼの活性を測ることが難しくなります。(図1)
図1
レーン1:ライゲーション反応前のサンプル
レーン2:ライゲーション反応後、SDS不含有のローディングダイを使用したもの
レーン3:ライゲーション反応後、SDS含有のローディングダイを使用したもの
レーン4:GeneRuler DNAラダーミックス
基質DNAとして、HindIIIで切断されたラムダDNAを使用することでもリガーゼの活性を測ることができます。このDNAは高純度のため、下記のプロトコルを行うのが簡単になります。
プロトコル
0.5 μg HindIIIで切断されたラムダDNAと
2 μL 10x T4 DNA Ligase bufferと
1ユニットのT4 DNAリガーゼを追加します (1×T4 DNA Ligase bufferで希釈が可能です)
全溶液量が20 μLになるように水で調製し、22°C (室温)で10分間反応させます。
結果
上記で述べたように、SDS含有のローディングダイを使用して、10 μLの反応液をアガロースゲル電気泳動に流します。ライゲーション反応後のサンプルでは、図 2で示すようにいくつかの高分子のバンドが現れるはずです。
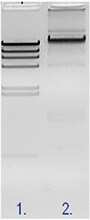 図2
図2
レーン1:ライゲーション反応前のラムダDNA
レーン2:ライゲーション反応後のラムダDNA
ラムダDNAを使用した場合にはライゲーションはうまくいくが、目的のサンプルを使用した際にライゲーションがうまくいかない場合は、リガーゼには問題はなく、サンプルに問題があると考えられます。これには、いくつかの理由が原因である可能性があります。弊社のテクニカルサポートは、このようなトラブルシューティングを支援いたします。
これだけは知っておきたいクローニングの基礎知識、ココにあります!
Invitrogen 分子生物学教室では、分子生物学の教育のメインとして、初心者だけでなく経験のある分子生物学者のために、豊富で信頼できる技術的な内容をご提供しています。基礎知識を学ぶ時にはいつでも、Invitrogen 分子生物学教室の無料PDFを活用してください!
研究用にのみ使用できます。診断用には使用いただけません。




