アガロースゲル電気泳動法は、PCR産物や制限酵素消化断片など二本鎖DNAの解析に使える簡単で便利な方法です。この技術はRNAの泳動にも使えますが、以下などの理由でDNAと比べて手間がかかります。
- RNAは一本鎖であるため二次構造を形成しやすく、変性ゲルを使って変性条件で電気泳動を行うのが一般的である
- 特にホルムアルデヒドを添加した変性ゲルの場合、ゲルの作成や電気泳動をドラフトチャンバー内で行う必要がある
- RNaseによる分解に注意する必要がある
本ブログでは、E-Gel™ EX Agarose Gelsを用いた簡易的なRNA電気泳動プロトコルと、そのプロトコル作成の参考にした検討結果をご紹介します。非常に簡単な方法で、サンプル調製から撮影まで約30分で行えます。また、本ゲルは変性ゲルではありませんが、以下の用途でしたら十分お勧めできます。
- Total RNA抽出後のチェック(とれているか、明らかな分解が起こっていないか)
- in vitro転写RNAのチェック(それらしいサイズのRNAができているか、明らかな分解が起こっていないか)
▼もくじ
E-Gel EX Agarose Gelsを用いた簡単RNA電気泳動プロトコル
主な使用製品
ゲル(使用できることを確認したもの)
(注意)E-GelにはSYBR™ Gold II色素を添加したE-Gel EXゲル(上記)の他に、SYBR™ Safe色素を添加したゲルもありますが、それらについては本用途での使用をお勧めできません(添加色素の感度が低いためRNA電気泳動には向きません。)。
電気泳動および撮影装置
- G8300 Invitrogen™ E-Gel™ Power Snap Electrophoresis System
- G9311 Invitrogen™ E-Gel™ Power Snap Plus Electrophoresis Systems with 1-year Standard Warranty
(注意)販売を終了したInvitrogen™ E-GelTM iBaseTM Power Systemも使用可能です。
RNAサイズマーカー(使用できることを確認したもの)
- AM7150 Invitrogen™ Millennium™ RNA Markers:0.5、1、1.5、2、2.5、3、4、5、6、9 kベースの10本のバンドを含む(0.5~1 µg程度/ウェル)
- AM7145 Invitrogen™ Century™-Plus RNA Markers:100、200、300、400、500、750、1,000ベースの7本のバンドを含む(1~2 µg程度/ウェル)
- SM1821 RiboRuler High Range RNA Ladder:200、500、1,000、1,500、2,000、3,000、4,000、6,000ベースの8本のバンドを含む(1 µg程度/ウェル)
- SM1831 RiboRuler Low Range RNA Ladder:100、200、300、400、600、800、1,000ベースの7本のバンドを含む(1 µg程度/ウェル)
(注意)ホルムアミド添加+熱処理を行われることをお勧めします。ただし、熱処理は上記1. と2. では必須ではありません。
プロトコル
サンプル調製(変性処理)
- RNAサンプルをヌクレアーゼフリー水で10 µLになるように希釈
- 10 µLのホルムアミド(>99%、終濃度約50%)を添加してトータル20 µLとする
- 70℃で10分間加温した後氷上で冷却
(注意)サンプル量に関して:Total RNAは100~500 ng/ウェル程度(28S・18Sのバンドを確認される際は100~250 ng程度、5.8S・5Sのバンドも確認されたい場合は250~500 ng程度)、in vitro転写RNAなどほぼ単一のRNA断片の場合は50~100 ng程度が適量です。
(注意)上記変性処理は必須ではなくサンプルの種類・解析目的によってはスキップも可能ですが、変性処理による悪影響は確認されていませんので全てのケースで行われることをお勧めします。例えばリボゾーマルRNA(rRNA)の存在を確認する目的であれば、変性処理なしあるいはホルムアミド添加のみ(熱処理なし)でも通常問題ありません。
(注意)他の変性剤(グリオキサール、ホルムアルデヒド、尿素)については有効性が確認できませんでした。
電気泳動
ゲル(E-Gel EX Agarose Gels 1%あるいは2%)の各ウェルに20 µLサンプルをアプライし標準プロトコルで電気泳動(10分~12分程度)
(注意)ゲルの全ウェルにサンプル、あるいはヌクレアーゼフリー水等を20 µLアプライしてください。
(注意)rRNAの28S・18Sのみ確認されたい場合は1%ゲルがお勧めです。5.8S・5Sのバンドも確認されたい場合は2%ゲルがお勧めです。
(注意)電気泳動後数分間室温でゲルを放置すると検出感度が上がる傾向があります。
(注意)泳動後ゲルを急冷、あるいは長時間放置するとゲル中の泡の発生が顕著になる傾向があります。
参考データ集
以下2つの資料を参考に上記プロトコルを作成しました。
特にご参考になりそうな検討データを上記記事からご紹介します。
RNAサイズマーカーの電気泳動条件の検討
以下2種のマーカーを使って電気泳動条件を検討した結果をご紹介します(図1)。
Millennium RNA Markers(図1. A)、Century-Plus RNA Markers(図1. B)
総RNA量は0.5、2、4 µgの3通り、ホルムアミド添加の有無、熱処理の有無について泳動結果を比較しました。
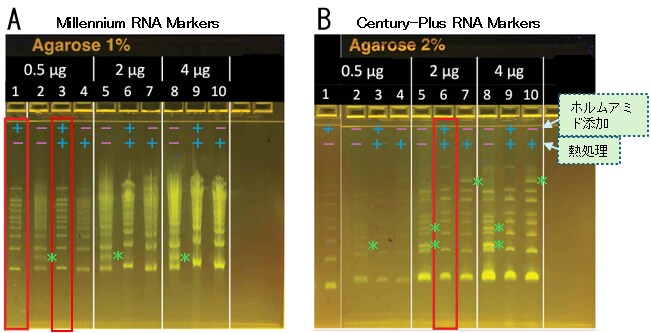
図1. RNAサイズマーカーの電気泳動結果
A: Millenium RNA Markers(E-Gel EX 1%ゲル)、B:Century-Plus RNA Markers(E-Gel EX 2%ゲル)。RNA量は0.5、2、4 µgの3パターン、ホルムアミドは添加・未添加(+・-)の2パターン、熱処理あり・熱処理なし(+・-)の2パターンについて試した。それぞれについて試した中で最適と思われる結果を赤枠で囲った。*:ゴーストバンド(RNAの2次構造形成により出現したと思われるバンド)。
変性処理について
変性処理を行わないと、スメアやゴーストバンドが見られました(例:スメアはAのレーン2および5、ゴーストバンドはBのレーン3および8の*で示したバンド)。これらの問題はホルムアミドを添加することで解消されました(例:Aのレーン1、Bのレーン1)。一方、熱処理だけでは完全には解消されませんでした(例:Bのレーン7、10)。なお、今回試した両マーカーでは、ホルムアミド添加後の熱処理で大きな変化はありませんでしたが(例:Aのレーン1と3)、RiboRuler High Range RNA LadderおよびRiboRuler Low Range RNA Ladderではホルムアミド処理後でもゴーストバンドがみられ、追加の熱処理により改善されました(データ非掲載)。
以上から、RNAサイズマーカーにはホルムアミド添加が有効であり、追加の熱処理が有効なケースもあることがわかりました。また、それぞれのマニュアル記載の変性ゲルでの泳動結果と比較して、バンドの数が異なる等の大きな違いは確認できませんでした。他のRNAサイズマーカーをご使用いただく場合は念のためホルムアミド添加+熱処理の条件をお試しいただくのがお勧めです。
RNA量に関して
Millennium RNA Markersの場合は試した中で0.5 µgが最も良く、2 µgは少し過剰であることがわかりました。一方Century-Plus RNA Markersの場合は2 µgが最も良く、0.5 µgでは少し少ないことがわかりました。なお、バンド毎の正確なRNA量は不明ですが、Millennium RNA Markersの場合は10本比較的同じ強度のシグナルのバンドが観察されました。そのことから一本あたり50 ng程度が適量だと予測されました(0.5 µg/10 = 50 ngという計算)。
Total RNAの電気泳動条件の検討
次に、universal human reference RNA(UHRR)を用いてtotal RNAの泳動条件を検討した例をご紹介します(図2)。RNA量が250~4,000 ngの10パターンになるようにし、1%と2%のゲルにアプライしました。変性処理はホルムアミド添加のみで熱処理は行っていません。
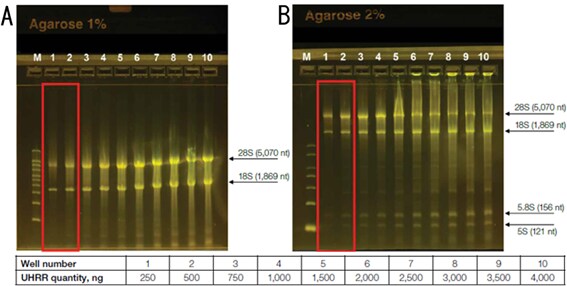
図2. UHRRの電気泳動結果
A: E-Gel EX 1%ゲル、B: E-Gel EX 2%ゲル。RNAが250~4,000 ngになるようにそれぞれのゲルにアプライした。全てにホルムアミドを添加した。それぞれについて試した中で最適と思われる結果を赤枠で囲った。AのM:Millennium RNA Markersを250 ng、BのM:Century-Plus RNA Markersを500 ng。
28Sと18Sのバンドを確認する場合は1%ゲルに250 ng程度のTotal RNAを流すのが良さそうです。また、5.8S、5Sのバンドも確認されたい場合は2%ゲルに250~500 ng程度流すのが良さそうです。なお、少なくともrRNAのバンドを確認する事が目的であれば、変性処理はホルムアミド添加のみで十分そうです。なお、データは示しませんが、変性処理なし(ホルムアミド添加もなし)でも追加の熱処理を行っても結果はほとんど変わりません。rRNAの簡易的なチェックが目的であればそのまま変性処理なしで流しても問題無さそうです。
RNAフラグメントの電気泳動条件の検討
最後に、in vitro転写で合成したRNAフラグメントの電気泳動条件を検討した例をご紹介します(図3)。サイズの異なる4種のRNAフラグメント(868、1,017、2,716、4,525ベースの4種類)を1%ゲルに流しました。変性処理はホルムアミド処理したもの(図3. A)と、その後に熱処理も行ったもの(図3. B)の2通りを試しました。合成後簡易精製を行ったフラグメントと未精製のフラグメント両方を流し比較しました。
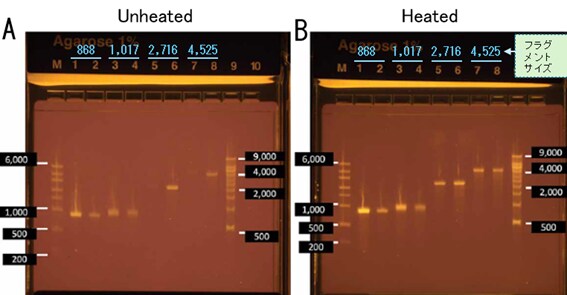
図3. サイズの異なる4種のRNAフラグメントの電気泳動結果
A: 熱処理なしB: 熱処理あり。共にE-Gel EX 1%ゲル。RNAフラグメントのサイズは868、1,017、2,716、4,525ベースの4種類。全て100 ng。M:RiboRuler High Range RNA Ladder(1 µg)、9:Millennium™ RNA Markers(1 µg)。1、3、5、7:未精製サンプル、2、4、6、8:精製サンプル。
ホルムアミド添加後に熱処理を行った場合、マーカーと比較して4種ともそれらしいサイズのバンドが確認できました。E-Gel EXゲルは変性ゲルではありませんが、サンプルの前処理を行うことにより、ある程度RNAのサイズに応じた分画が可能だとわかりました。なお、熱処理を行わない場合は行った場合と比べて全体的にうすく、一部バンドの確認が難しいものがありました。未精製サンプルでその傾向が強い結果でしたが、その理由は不明です。配列依存でバンドがうすくなるのかどうかはっきりしませんが、ホルムアミド処理+熱処理によりその問題は解消されました。
まとめ
E-Gel EXゲルは変性ゲルではありませんが、DNAだけでなくRNAの電気泳動にもある程度使えそうなことがわかっていただけたのではないでしょうか。
もしTotal RNA、in vitro転写RNAのチェックを電気泳動で行われたい場合は、ぜひ一度お試しください。結果のご報告をお待ちしております!
E-Gel Power Snap・ E-Gel Power Snap Plusのデモ依頼・訪問依頼はこちらから
研究用にのみ使用できます。診断用には使用いただけません。



