ジェネティックアナライザのアプリケーションの1つであるフラグメント解析では、PCRなどにより得られた蛍光標識DNA断片の長さを解析することで、間接的に塩基配列に関する情報を知ることができます。例えば、「マイクロサテライト解析」では、特定塩基の繰り返し数に注目した解析をします。具体例としては、繰り返し領域の中で、個体間で異なる繰り返し数は、親子判定や個体識別に有効なDNAマーカーとして利用されています。
フラグメント解析のワークフロー例を図1に示します。まず、蛍光標識されたプライマーを用いて目的領域をPCR増幅し、得られたPCR産物とサイズスタンダード(長さ既知の蛍光標識DNA断片)を混合し、電気泳動を行います。サイズスタンダードのピークから作成した検量線を用いることで、対象ピークのサイズ値を算出します。フラグメント解析では、標識された蛍光色素の種類やPCR産物の長さが異なれば、複数のPCR産物を混合して泳動できます。

図1:フラグメント解析のワークフロー例
多くのDNAポリメラーゼは、2本鎖DNAの3´末端にアデノシンを付加する性質があります。PCRの工程で、このアデノシンの付加が起こると、電気泳動の結果得られるエレクトロフェログラムでは、1塩基大きなサイズ値にピークが検出されます。このピークはPlus A(+A)ピークと呼ばれます。付加効率は、鋳型の5´末端の配列にも依存することが知られており、配列によっては、付加されなかったDNAのピーク(-Aピーク)と、+Aピークのダブルピークとなり、結果が不正確になる恐れがあります。この対策の1つに、5´末端にTail配列を持つリバースプライマーの利用があります。Tail配列は3´末端へのアデノシンの付加を促す7塩基の配列であり、Tail配列を含むプライマーを用いることで、+Aの単一ピークに近づけることができます。
当社ラボでフラグメント解析の実験系を検討していたところ、同じPCRプライマーを用いても、PCR試薬や混ぜるプライマーの数(量)により、+Aピークの検出状況が異なる結果が得られました。もしかしたら、同じ状況に遭遇する方がいるのでは、と思い、今回は、PCRの反応条件による+Aピークの違いについての実験結果をまとめました。
実験
使用試薬
- Applied Biosystems™ Control DNA (from CEPH Individual 1347-02)
- Applied Biosystems™ AmpliTaq Gold™ 360 Master Mix
- Applied Biosystems™ Platinum™ Multiplex PCR Master Mix
- PCRプライマーペア 4種(フォワードプライマーの5’末端に蛍光標識、リバースプライマーの5’末端にTail配列付加)
- Applied Biosystems™ GeneScan™ 600 LIZ™ dye Size Standard v2.0
- Applied Biosystems™ Hi-Di™ ホルムアミド
使用機器
- サーマルサイクラー:Applied Biosystems™ ProFlex™ PCR System、Veriti™ サーマルサイクラー
- ジェネティックアナライザ:Applied Biosystems™ SeqStudio™ ジェネティックアナライザ
実験
Control DNA CEPH 1347-02をテンプレートDNAとし、4つのマイクロサテライトマーカー(表1)を用いて検証を行いました。
| マーカー | 蛍光 |
| A | 6-FAM™ 色素 |
| B | PET™ 色素 |
| C | NED™ 色素 |
| D | VIC™ 色素 |
<PCR>
PCR試薬は、AmpliTaq Gold 360 Master Mix(以下、AmpliTaq Gold 360)と、Platinum Multiplex PCR Master Mix(以下、Platinum Multiplex)を用い、それぞれ、表2、表3の組成で反応液を調製しました。Platinum Multiplexでは、1つのプライマーペアのみを添加した反応液と、4つのプライマーペア全てを混合した反応液の、2種の反応液を用意しました。PCRの温度条件は、表4 (AmpliTaq Gold 360)、表5(Platinum Multiplex)に示した通りです。なお、反応液の組成、PCR条件は、AmpliTaq Gold 360およびPlatinum Multiplexの推奨条件[1, 2]を参考に決定しました。
| 組成 | 容量/反応 | 終濃度 |
| PCR Master Mix (X2) | 12.5 µL | X1 |
| Template DNA (10 ng/µL) | 1 µL | 0.4 ng/µL |
| Primer pair (10 µM each) ※1 | 1 µL | 400 nM each |
| Nuclease Free Water | 10.5 µL | – |
| Total | 25 µL | – |
| ※1 : 1プライマーペア/反応液 | ||
| 組成 | 容量/反応 | 終濃度 |
| PCR Master Mix (X2) | 12.5 µL | X1 |
| Template DNA (50 ng/µL) | 1 µL | 2 ng/µL |
| Primer pair ((0.5~1 µM each) ※2 | 2.5 µL | 50~100 nM each |
| Nuclease Free Water | 9 µL | – |
| Total | 25 µL | – |
| ※2 : 1プライマーペア/反応液、または、4プライマーペア/反応液 | ||
| Step | ||||||
| Hold | 30 Cycle | Hold | Hold | |||
| Temp. | 95 ℃ | 95 ℃ | 60 ℃ | 72 ℃ | 72 ℃ | 4 ℃ |
| Time | 10 min | 30 sec | 30 sec | 1 min | 7 min | ∞ |
| Step | ||||||
| Hold | 30 Cycle | Hold | Hold | |||
| Temp. | 95 ℃ | 95 ℃ | 60 ℃ | 72 ℃ | 60 ℃ | 4 ℃ |
| Time | 2 min | 30 sec | 1min 30 sec | 1 min | 30 min | ∞ |
<泳動サンプルの調製>
希釈したPCR産物を、下表の組成で、サイズスタンダード、Hi-Diホルムアミドと混合し、泳動サンプルとしました。
| Component | Volume |
| PCR sample | 1 µL |
| GeneScan 600LIZ dye Size Standard v2.0 | 0.2 µL |
| Hi-Di Formamide | 9.8 µL |
<電気泳動>
ランモジュールはFragAnalysis、Dye SetはG5の設定で、電気泳動を行いました。
結果
各マイクロサテライトマーカーのエレクトロフェログラムを図2に示します。AmpliTaq Glod 360を用いた場合(図2 上段)、いずれのマーカーでも、メインのアレルピークに対し、2 bpずつ小さいサイズ値にピークが検出されました(図2 *で表示)。マーカーA~Dはいずれも、2塩基単位の繰り返し配列を含みます。このようなマーカーのPCRを行うと、メインのアレルのPCR産物に比べて2塩基単位(2、4、…、塩基)分短い断片が副産物として生じ、ピークとして検出されます。これらは、スタッターピークと呼ばれます。また、サンプルがヘテロで、両アレルの繰り返し数が1つ違いの場合、小さい方のアレルピークに大きい方のスタッターピークが重なります。マーカーDの184.5 bpのピークが、これに該当します。
Platinum Multiplexを用い、1反応液に1プライマーペアを添加してPCRを行い(1マーカー/反応)得られた結果を、図2下段に示します。AmpliTaq Glod 360を用いた場合にみられたピークに加え、これらのピークより1 bp大きいサイズ値にも、ピークが検出されました(図2 ▽で表示)。これは、3´末端へのアデノシン付加により生じた副産物と考えられます。これに対し、1反応液に4プライマーペアを混合してPCRを行った(4マーカー/反応)結果、+1 bpのピーク強度は大幅に低減し、AmpliTaq Glod 360を用いた場合とほぼ同様のエレクトロフェログラムが得られました。
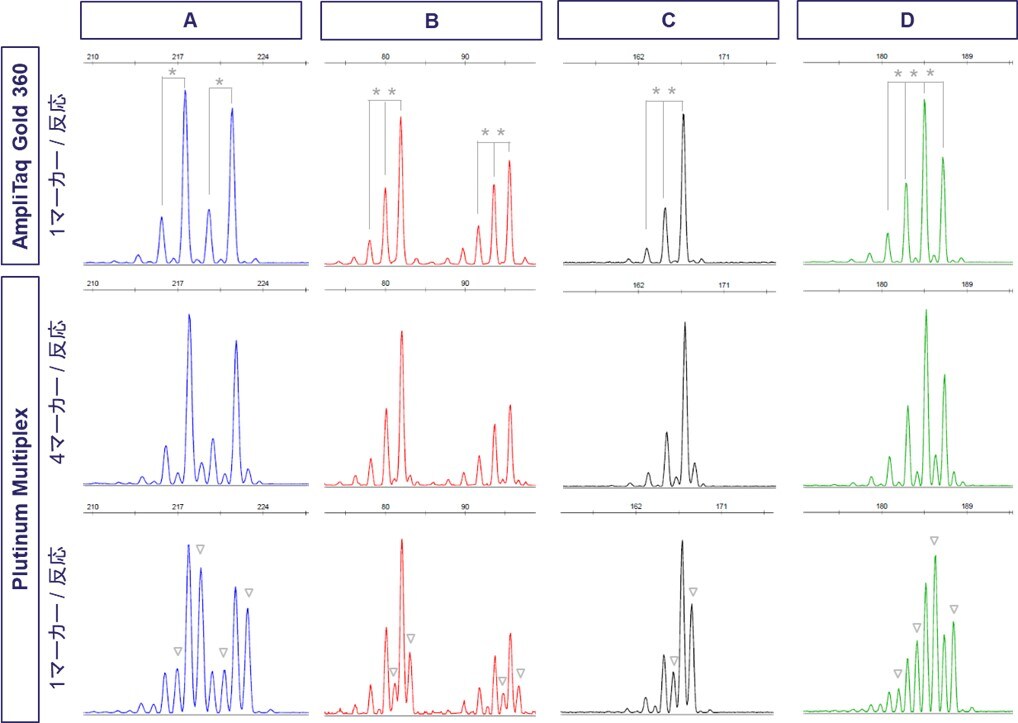
図2:各マイクロサテライトマーカーのエレクトロフェログラム(横軸:bp)
*で示したピーク間のサイズ値の差異は2 bp
▽で示したピークのサイズ値は、波形中の左隣のピークサイズ値に対し+1 bp
今回の実験では、Tail配列を含むPCRプライマーを用いたため、-Aピークは生じにくいと考えられます。これより、AmpliTaq Gold 360を用いた結果で検出されたピークは+Aピークであり、Platinum Multiplexでみられた、1 bp大きなサイズ値のピーク(図2 ▽)は、もう1つアデノシンが付加されたピーク(以下、+AAピーク)であると推測されます。Platinum Multiplexを用い、1マーカーのみのPCRを行った場合は、反応基質が過剰となり+AAピークが高いシグナル強度で検出され、4マーカー/反応でのPCRでは、反応液中のプライマー総量が増えたことで基質が消費されたため、+AAピークが低減したと考えています。
まとめ
実験の結果、PCR試薬やプライマー総量の違いにより、+Aピークの検出状況は異なることが分かりました。さらに、Tail配列を含むプライマーを用い、マルチプレックスPCRに適した条件でPCRを行うと、プライマー総量が少ない場合は、+AAピークが検出される可能性があることが示唆されました。このような場合、プライマー総量を増やすことが、+AAピークを低減させ、+Aの単一ピークに近づける対処法の1つになることが、今回の実験結果から分かりました。
フラグメント解析ユーザーガイド
サンガーDNAシーケンサのデモ、資料、見積もりなどにご興味がありましたら、下記のリンクからお気軽にお問い合わせください。
https://www.thermofisher.com/jp/ja/home/life-science/pcr/resources.html
参考資料
1. AmpliTaq Gold® 360 Master Mix Protocol
2. Platinum™ Multiplex PCR Master Mix USER GUIDE
研究用にのみ使用できます。診断用には使用いただけません。