Trypsinは接着細胞の継代に使用される代表的なタンパク質分解酵素です。細胞接着分子の消化作用によって細胞同士の接着と細胞とディッシュとの接着の解離を促します(関連記事)。Trypsinは細胞接着分子に限らず細胞表面のタンパク質を消化するので、過剰な処理は細胞へのダメージにつながります。そのため、細胞解離においては必要最小限のTrypsin処理とするのが定石になっています。では、細胞がTrypsinに曝され続けると何が起こるのでしょうか?今回は、ディッシュから剥がしたHeLa細胞をTrypsinで処理し続けながら、生存率、細胞の濃度などを追跡してみました。
▼もくじ [非表示]
実験方法
・細胞:
サブコンフルエントのHeLa細胞
・手順
- 培地をアスピレートしてGibco™ DPBS(製品番号14190144)でリンス
- Gibco™ Trypsin(0.25%)Phenol Red含有(製品番号15050065、図1)を添加
- CO2インキュベーターでインキュベーション
- 軽くディッシュを叩いてほとんどの細胞が剥がれたことを確認してから、ウシ胎仔血清入りのDMEM(完全培地)を加えてTrypsin処理を停止
- 細胞懸濁液をチューブに回収して遠心分離
- 上澄みをアスピレートして新鮮な完全培地で再懸濁
- Gibco™ Trypan Blue 0.4%溶液(製品番号15250061)と細胞懸濁液を1:1で混合してInvitrogen™ Countess™ Chamber Slide(製品番号C10283)に注入
- Invitrogen™ Countess™ 3 FL自動セルカウンターの明視野モード(デフォルト設定)で自動セルカウント
- この時の生存率は平均96.5%、細胞濃度は2.1 x 106 cells/mL。この時点を処理時間0分と設定
- 処理時間0分の測定後、遠心分離して上澄みをアスピレートし、DPBSで細胞を洗浄
- 再度遠心分離して0.25% Trypsinに再懸濁
- 37℃の温浴でインキュベートを再開
- 10、20、30、40、60分後にサンプリングしてCountess 3 FLで自動セルカウント

図1. Trypsin (0.25%), phenol red
過剰なTrypsin処理が生存率と細胞濃度の測定に及ぼす影響
それでは測定結果を見ていきましょう。Trypsin処理による生存率と細胞濃度の変化をグラフ化しました(図2、図3)。
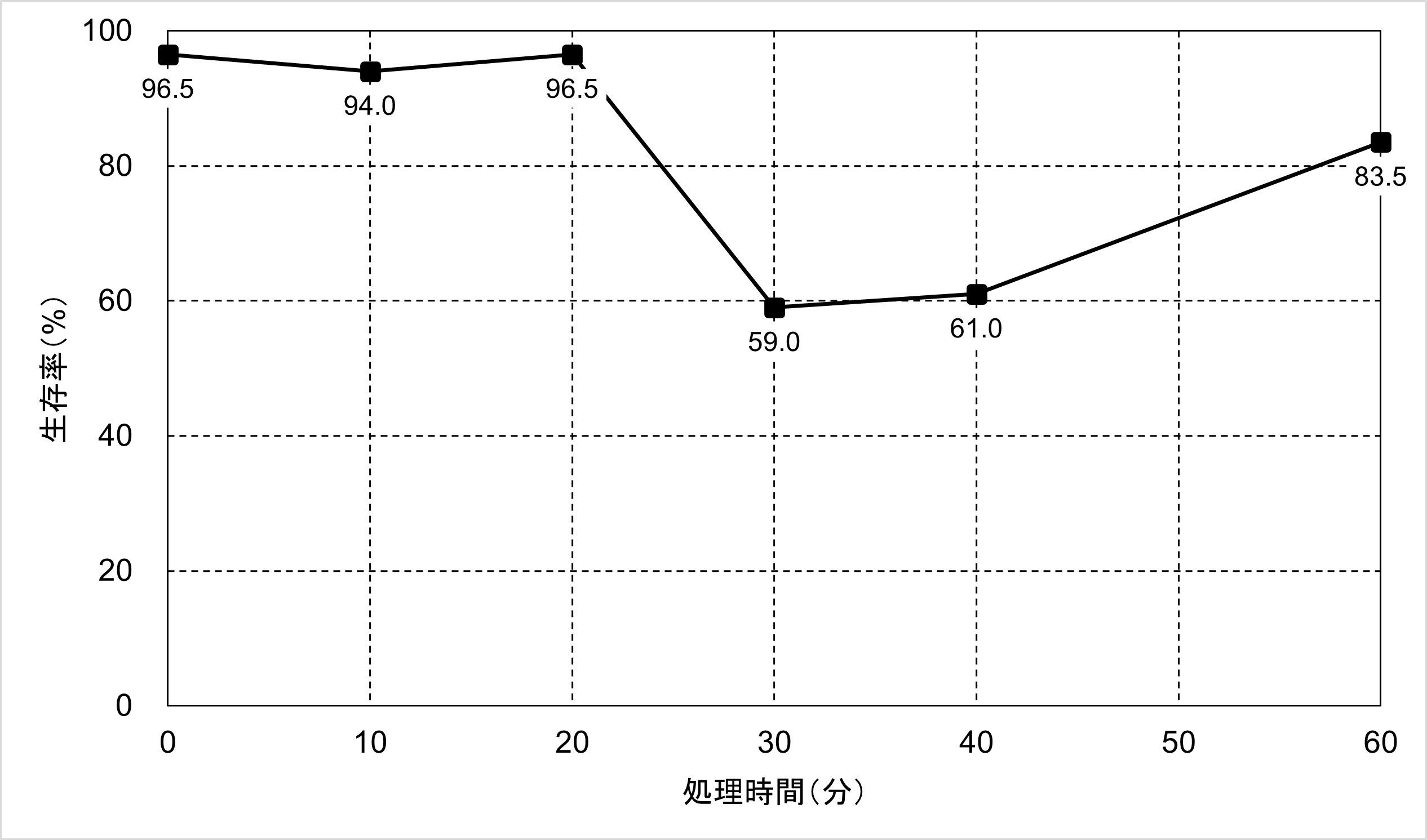
図2. 過剰なTrypsin処理による細胞の生存率の変化
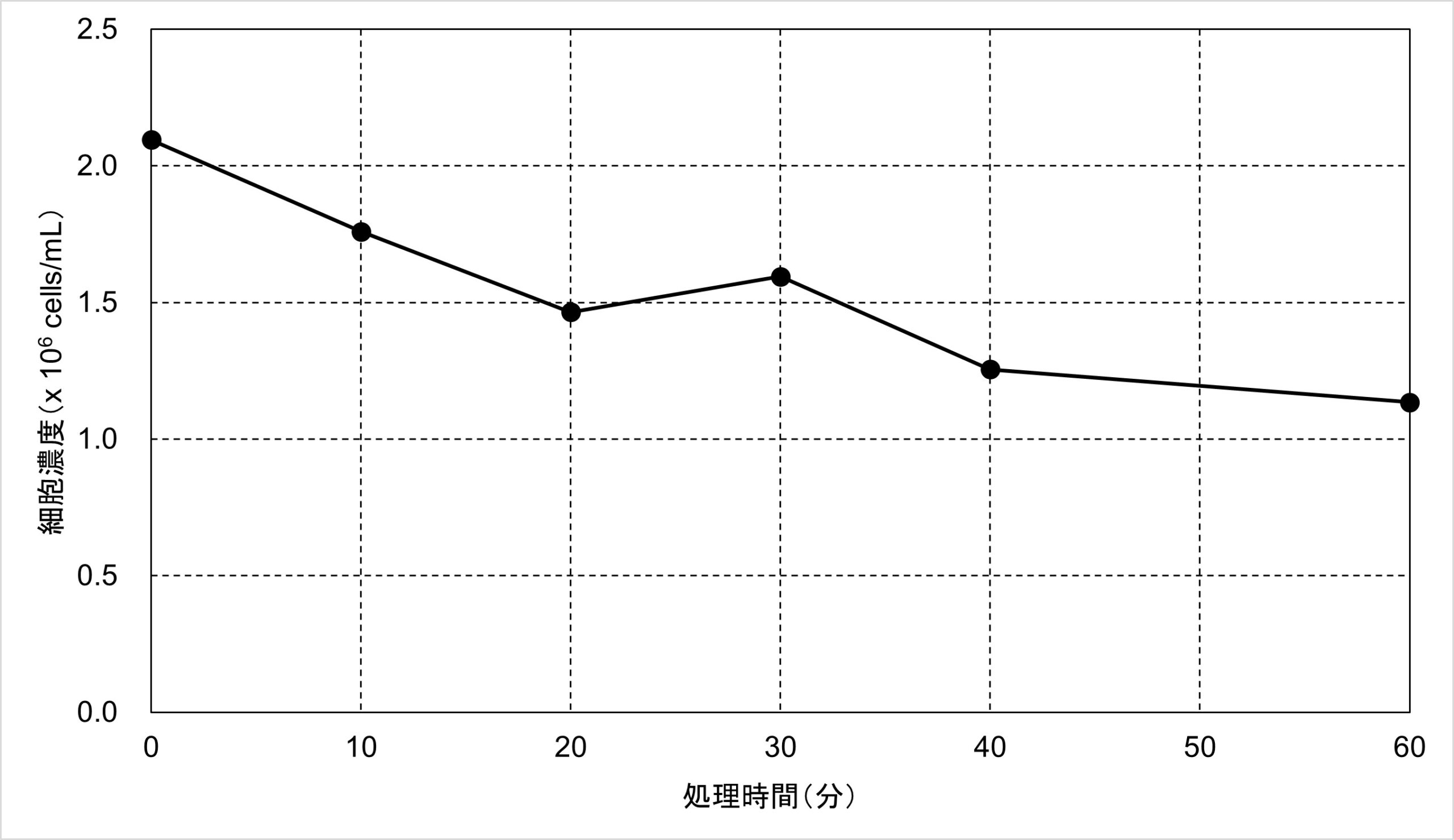
図3. 過剰なTrypsin処理による細胞濃度の低下
処理時間20分までは95%程度の生存率を維持していました。一方、細胞の濃度は2.1 x 106 cells/mLから1.5 x 106 cell/mLまで、3割ほど低下しました。これはTrypsinによってダメージを受けた細胞が壊れるなどしてCountess 3 FL自動セルカウンターによるセルカウントの対象外になったためだと考えられます。そして処理時間30分で生存率が59%へ大きく低下しました。処理0分と30分の細胞の様子と生死判定結果を図4にまとめました。また、処理60分では、30分や40分よりも生存率が高いという結果が出ました。これは過剰なTrypsin処理によって発生した多数の細胞の破片が生細胞と判定されたためだと考えられます。こちらについては解決方法を含めて追って解説していきます。
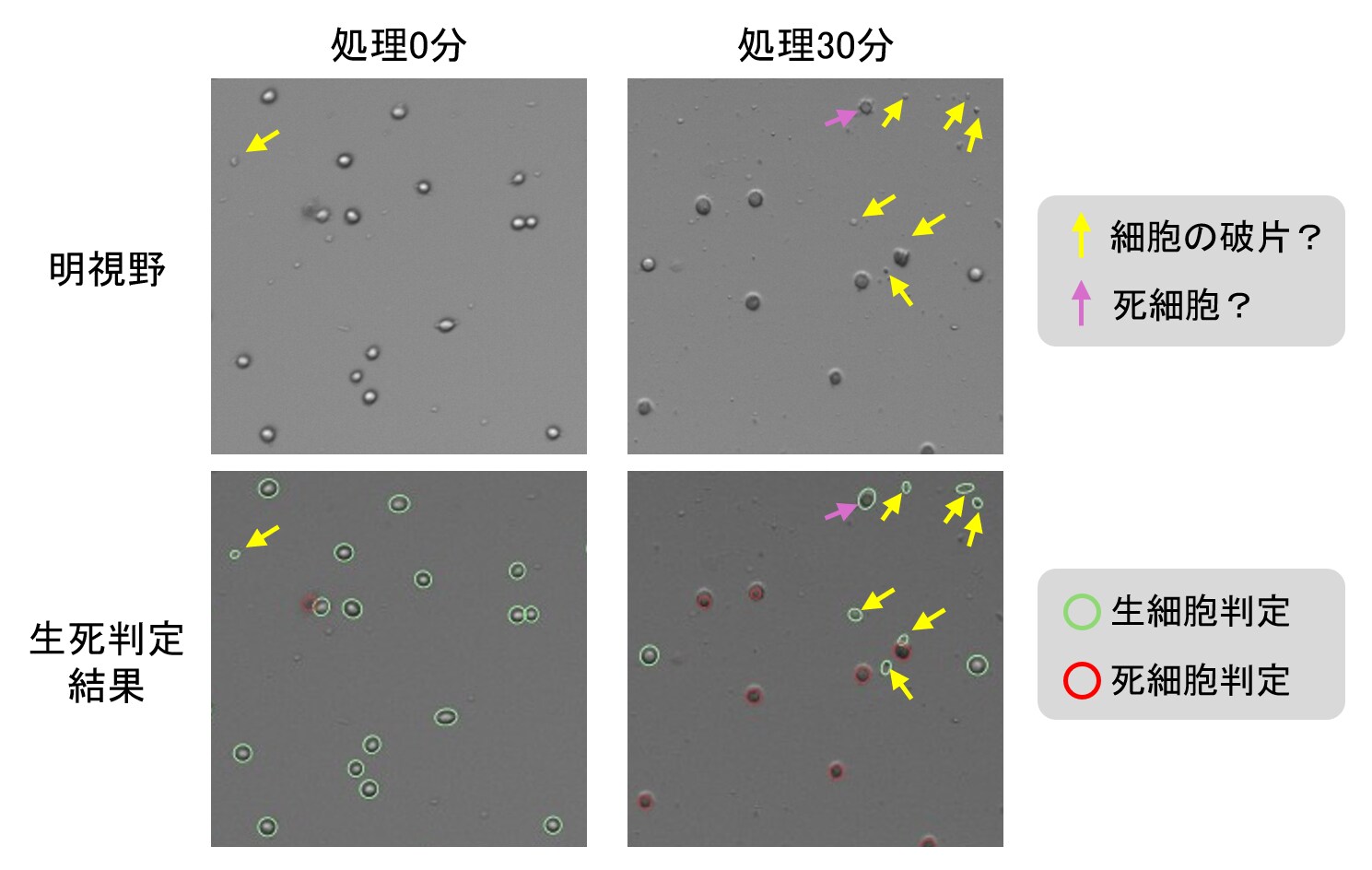
図4. 処理0分と30分後の細胞の状態比較
今回は自動セルカウンターCountess 3 FLでセルカウントしました。Countess 3 FLは、細胞の写真を撮影し、独自の画像解析アルゴリズムで細胞を特定して生死判定・濃度測定を行います。撮影した画像を確認しながら、細胞の大きさ、明るさ、真円度の3つのパラメーターの閾値を調節して、測定対象の細胞を設定できます。ですが今回はあえてデフォルト設定で自動セルカウントを行ったところ、2つの面で判定結果に疑問が生じました。
図4において、処理0分と30分のどちらの写真にも、典型的な大きさの細胞よりも小さい粒子(細胞の破片?、黄色矢印)があり、生細胞判定されています。これらの粒子は細胞ではないと判断してカウントから除外するのが一般的です。撮影後のパラメーター調整において、Countess 3 FL自動セルカウンターに測定対象と認識させる細胞の大きさの閾値を調節することで対応できます(図5)。処理0分では小さい粒子はわずかのため測定結果にほとんど影響しないと考えられます。しかし、処理30分では多数の粒子が存在していたため、これらを除外して計算し直すと生存率が大きく低下したはずです。
また、多くの生細胞よりも明るさが暗い(トリパンブルーで染まっている)にもかかわらず生細胞と判定されている細胞がありました(紫色矢印)。よく見ると、死細胞と判定された細胞よりもわずかに明るいため、生細胞と判定されたようでした。この場合は、撮影後のパラメーター調整において、細胞の明るさの閾値を調節する必要があります(図5)。
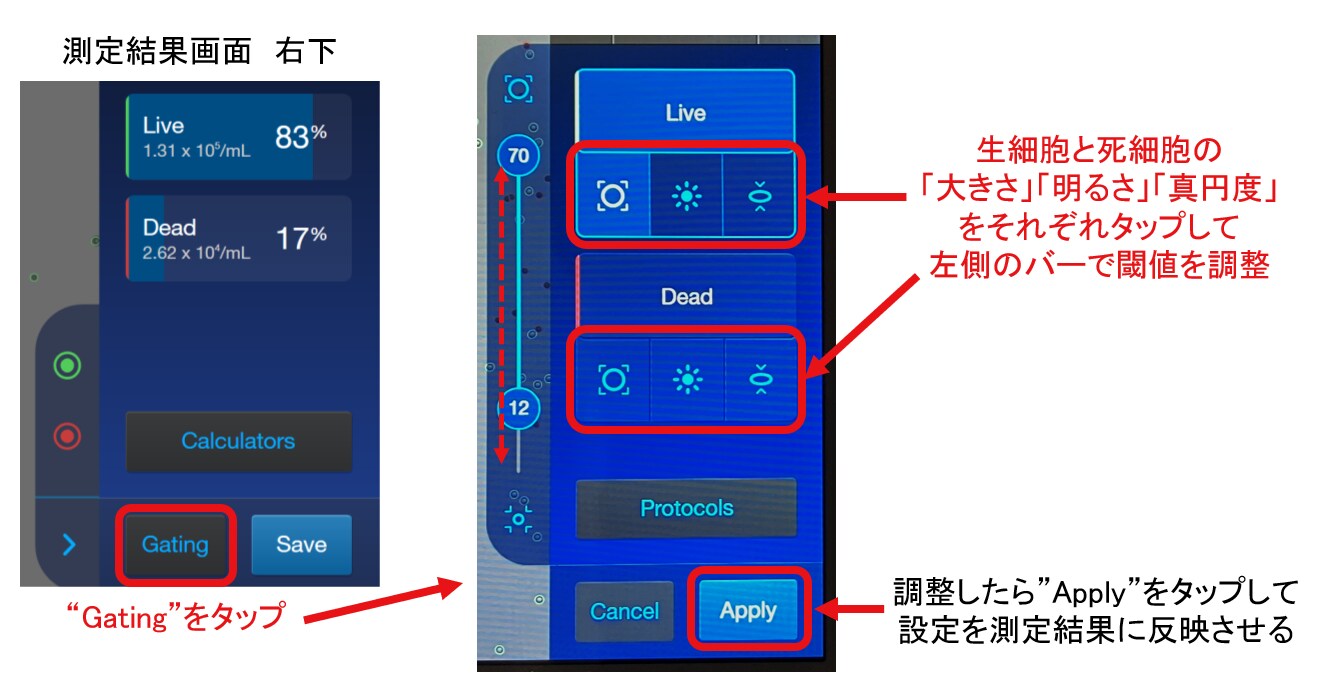
図5. Countess 3/3 FLのパラメーター設定画面
以上のことから、処理30分の実際の生存率は59%よりも低かったと考えられます。ここではあえてデフォルト設定で測定しましたが、実際の測定ではサンプルの状態を見ながら適切にパラメーターを調整して正しい結果を出力するように導く必要があります。処理60分で生存率が上昇しましたが、Countessのパラメーターを適切に調整していればもっと低い(正しい)結果が得られたと考えられます。
自動セルカウントにおけるパラメーター調整の重要性
そこで、Countess 3 FLのパラメーター調整が結果にどの程度影響するのかを確かめてみました。60分間Trypsin処理したHeLa細胞を自動セルカウントし、デフォルト設定とパラメーター調整後の結果を比較しました。図6のように、デフォルト設定では典型的なHeLa細胞よりも小さい多数の破片が生細胞として認識されていました(図6左上)。そこで、パラメーター設定画面で生細胞として認識させる細胞の大きさの閾値を上げて、破片をカウント対象から除外しました(図6左下)。その結果、デフォルトでの全細胞濃度は1.0 x 106 cells/mL、生細胞率は90.8%、生細胞濃度は0.91 x 106 cells/mLでしたが、調整後は全細胞濃度が0.66 x 106 cells/mL、生細胞率が85.3%、生細胞濃度は0.55 x 106 cells/mLとなりました。この実験例では、パラメーターの調整をしないと生細胞の濃度を実際よりも約1.6倍大きく見積もってしまうことがわかりました。
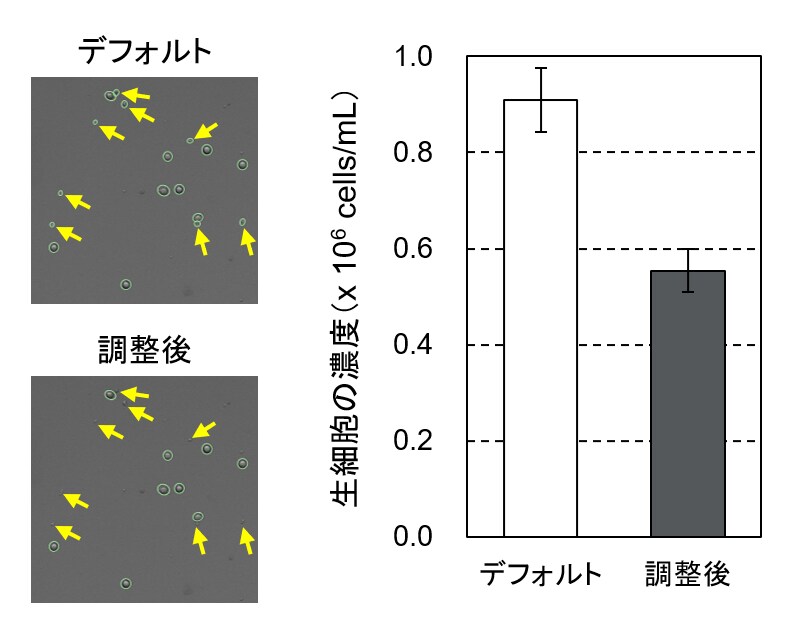
図6. 自動セルカウントにおけるパラメーター調整の重要性
なお、このようなことが起きた原因は、Countess 3/3FL自動セルカウンターのアルゴリズムがデフォルトでは最小4 μmの大きさの細胞を認識できるようになっているからです。自動セルカウンターとしては血球系の細胞など、HeLaよりも小さな細胞の測定に対応できる必要があります。今回は過剰なTrypsin処理をした極端な事例ではありますが、オルガノイドをシングルセル化するなど、培養細胞の継代時よりも強い酵素処理が必要な時には考慮するとよいかもしれません。
過剰なTrypsin処理で細胞の接着効率が低下する
最後に、Trypsinで60分間処理した細胞を培養ディッシュに播種し、一晩培養しました(図7)。同日に播種した処理0分の細胞は翌朝にはしっかりディッシュ底面に接着していました。一方、Trypsinで60分間処理された細胞は、一晩培養しても接着が不十分で、また、接着できなかった細胞も多数見られました。過剰なTrypsin処理は生き残った細胞のその後の培養に悪影響を残していることがわかりました。
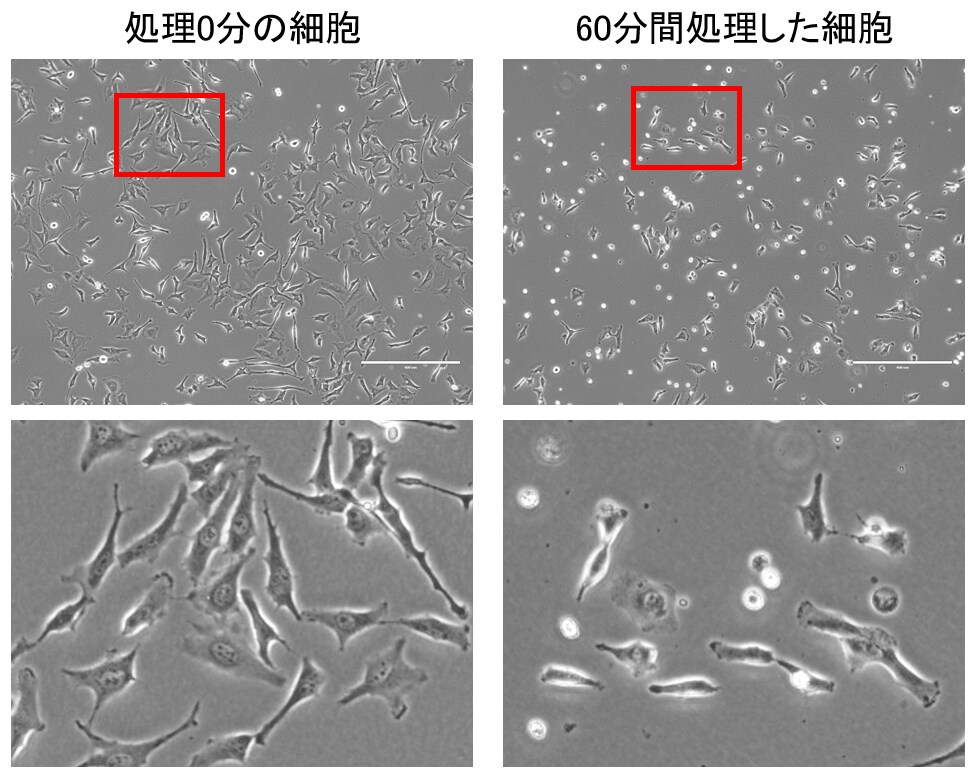
図7. 過剰にTrypsin処理された細胞は接着しにくくなる
まとめ
今回、本来は必要最小限とすべき細胞へのTrypsin処理をわざと過剰に行いました。その結果、生存率の低下、細胞濃度の低下、接着効率の低下など、予想通りの悪影響が確かめられました。培養細胞の継代の際は、最短時間でTrypsin処理を行うようお勧めします。
また、細胞の生存率や濃度の測定にトリパンブルーと自動セルカウンターCountess 3 FL(明視野モード)を使用しましたが、正しく測定するにはCountessのパラメーター設定も大事であることがわかりました。手動でセルカウントする時には、見ているものが測定すべき細胞か除外すべき破片か、トリパンブルーの染まり具合などを測定者の基準で瞬時に判断しているはずです。Countessを使いこなすコツは、パラメーター設定などを通して測定者の判断基準を自動でのセルカウントにどれだけ反映させられるか、と言えます。Countess自動セルカウンターをデフォルト設定のまま使用中で、測定結果に違和感がある場合は、ぜひパラメーター設定を見直してみてください。
細胞の継代やセルカウントについてもっと知りたい方は無料オンラインセミナー「これから始める人は必見!細胞培養のキホンのキ」、「いまさら聞けない!細胞カウントを基本から学ぼう」や講義と実習で細胞培養の基本を習得できる細胞培養ハンズオントレーニング(1日コース、2日間コース)の受講をご検討ください。これらのトレーニングの内容の違いについては関連記事を参考にしてください。今回の内容に限らず、細胞培養関連の製品・アプリケーションなどでご不明点がありましたらテクニカルサポート(jptech@thermofisher.com)へお気軽にお問い合わせください。
Gibco細胞培養ハンドブックダウンロード(2021年リニューアル版)
研究用にのみ使用できます。診断用には使用いただけません。