この10年でゲノム編集の技術は、めまぐるしい発展を遂げました。CRISPR (Clustered Regulatory Interspaced Short Palindromic Repeats)のような技術は、病理学的基盤の解明だけではなく、HIV、SARS-CoV-2などの感染症や、先天性疾患の治療法開発にまで可能性を広げました。DNAの修飾が細胞の機能に及ぼす影響を考慮すると、正確で信頼性の高いツールを用いて、このようなゲノム編集の性質を検証し、また理解することが非常に重要です。
そこで今回は、サンガーシーケンスによるゲノム編集効率検証ツール Applied Biosystems™ SeqScreener Gene Edit Confirmation Appついて、ご紹介いたします。
▼こんな方におすすめです!
・ゲノム編集を実施されている方
▼もくじ
CRISPRの出現
これまで、ゲノム編集にはTALENs (Transcription activator-like effector nucleases) や ZFNs (zinc finger nucleases)など他の手法が使われてきました。CRISPRはそれよりも新しい、シンプルなゲノム編集の手法です。2020年には、Emmanuelle Charpentierと、Jennifer Doudnaが、Cas9を介したDNA修飾システムの生化学的特性評価でノーベル化学賞を受賞しました。
本来CRISPRは、バクテリアや他の原核生物がウイルスやプラスミドから身を守るために用いる、適応的防衛のメカニズムのことです。端的に言うと、外来DNAの短い配列(スペーサー)が宿主のゲノムの繰り返し配列(リピート)に隣接し、その短い配列を宿主ゲノムに取り込むというメカニズムです。
そのスペーサー配列は、転写されてsmall RNAになると、ヌクレアーゼ(Cas9)と機能的な複合体を形成し、外来DNAを認識、消化します。このメカニズムは、後に真核生物のゲノムにも適応され、2013年に初めて、ヒトとマウスの細胞で改変が起きたことが確認されました。
遺伝子をターゲットとするには、その目的領域と相補性配列を持つ、ガイドRNA(gRNA)を設計します。このgRNAは、CRISPR/Cas9ヌクレアーゼ複合体を特定の配列に誘導します。ヌクレアーゼによって切断された部位は、非相同末端結合や鋳型指向性修復によって修復がなされます。TALENが標的となるDNA配列に合わせ、特異的な転写活性化因子様transcription activator-like(TAL)エフェクタータンパク質を必要とするのに対し、CRISPRはガイドRNA配列を切り替えるだけなので、遺伝子編集の応用にはCRISPRの方がはるかに容易です。
疾患研究におけるCRISPRを用いたアプリケーション
遺伝子疾患・感染症
筋ジストロフィー
CRISPRを用いたいくつかのアプリケーションは、身体の機能を著しく損なう疾患、重篤で生命を脅かす疾患の研究において実証されています。例えば、Bengtssonらは、CRISPR/Cas9を筋肉に特異的に発現させることで、デュシェンヌ型筋ジストロフィー(DMD)の動物モデルにおいて、遺伝子変異の修正にこのシステムが応用できることを示しました。[2]
遺伝子が改変されたマウスでは、筋肉にジストロフィンがしっかりと発現し、疾患に関連した表現型が改善されました。
この問題を解決するためには、高い感度と特異性を持つ診断テストが鍵となります。感度・特異性とは、ある動物が病気であるか、病気でないかを正しく分類する診断テストの能力を示すものです。
HIV
また、CRISPRは遺伝子疾患だけでなく、HIV感染症の治療戦略としても期待されています。HIVの治癒を実現するにあたり大きなネックとなるのは、ウイルスが宿主のゲノムに組み込まれるため、ウイルスの複製を抑制するために、感染者は生涯にわたって抗ウイルス治療を受けなければならないことです。最近のサルでの研究では、Cas9がHIVと近縁のウイルスであるシミアン免疫不全ウイルス(SIV)のプロウイルスDNAを、感染した血液細胞だけでなく、ウイルスの組織リザーバーからも除去し、その複製を防げる効果があることが示されました[3]
CRISPR/Cas9の継続的な改良
CRISPR/Cas9システムは、新たな問題に対して改良が続けられています。Cas12a、Cas12bなどのガイドRNAヌクレアーゼを含む、いくつかの新しいヌクレアーゼが発見・最適化され、サイズが小さいことや、プロトスペーサー隣接モチーフ(PAM)配列などの特徴とともに、標的の選択が拡大されています。
CRISPRによるSARS-CoV-2およびインフルエンザAのゲノム改変研究
これらのヌクレアーゼの強力なアプリケーションの1つは、いくつかの呼吸器系病原体のゲノムを含むRNAウイルスゲノムを直接標的とし、改変することです。Abbottらは、最近この戦略を用いて、SARS-CoV-2およびインフルエンザAウイルスのRNAゲノムを消化し、ヒト肺上皮細胞におけるウイルス複製を阻害する、概念実証研究を発表しました[4]。
Related: Sanger Sequencing Solutions for SARS-CoV-2 Research
ゲノム編集における編集効率の評価の重要性
ゲノム編集を行う際、編集を成功させるためのいくつかの考慮すべき点をご紹介します。
・ガイドRNAの種類によって、ターゲティングの効率は異なる
・CRISPR/Cas9複合体を細胞内に導入するために、さまざまな方法が利用可能である
(製品の詳細はこちらをご覧ください)
・細胞の種類によって、修復効率は異なる
・最後に、修復機構そのものが、ターゲット周辺配列において混合配列を作り出す
ゆえに、ゲノム編集においては、実験条件下での編集効率を見極めることが非常に重要です。
ゲノム編集実験におけるサンガーシーケンス
サンガーシーケンスは、ゲノム編集実験において編集効率の判定に有用なツールです。治療後の初代細胞集団からバルクDNAを抽出し、サンガーシーケンスを実施します。
この初代細胞集団には、編集されていない配列と、編集されヘテロ配列を含む細胞が混在している状態です。サンガーシーケンスで得られたこの混合集団の波形を見ると、編集されたゲノムと編集されていないゲノムが多数あることが分かります。集団内の正確な配列の識別は難しいかもしれませんが、すべての非野生型配列の相対的な量は、ゲノム編集効率の判定に役立つ情報です。
編集効率が十分に高い場合、ゲノム編集実験の次のステップとしては、目的の編集が施された細胞を分離させることです。方法としては、初代培養細胞を限界希釈して単一細胞にし、その細胞をクローニングで増殖させるのが一般的です。その後、サンガーシーケンスを用い、増幅させた各細胞における編集領域周辺の遺伝子編集の有無を確認します。これによって、細胞集団の正確な配列が得られ、下流のアプリケーションに利用することができます。
関連Page: キャピラリー電気泳動を用いた CRISPR および TALEN 遺伝子編集の確認
新しいツールによるサンガーシーケンス解析の簡素化
より多くの情報と、より優れた画像
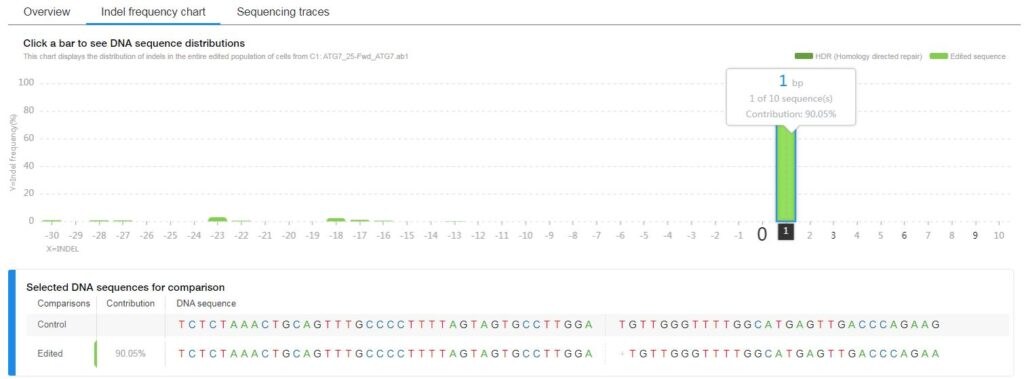
編集効率は、サンガーシーケンスの波形から目視で確認することができますが、ソフトウエアツールを使用することで、より多くの情報とより優れた画像を取得することができます。このようなデータ解析を迅速に行うために、サーモフィッシャーサイエンティフィックは、新しい遺伝子編集ソフトウェアソリューション、「SeqScreener Gene Edit Confirmation App 」を開発しました。
機能が豊富なソフトウエア
領域と頻度
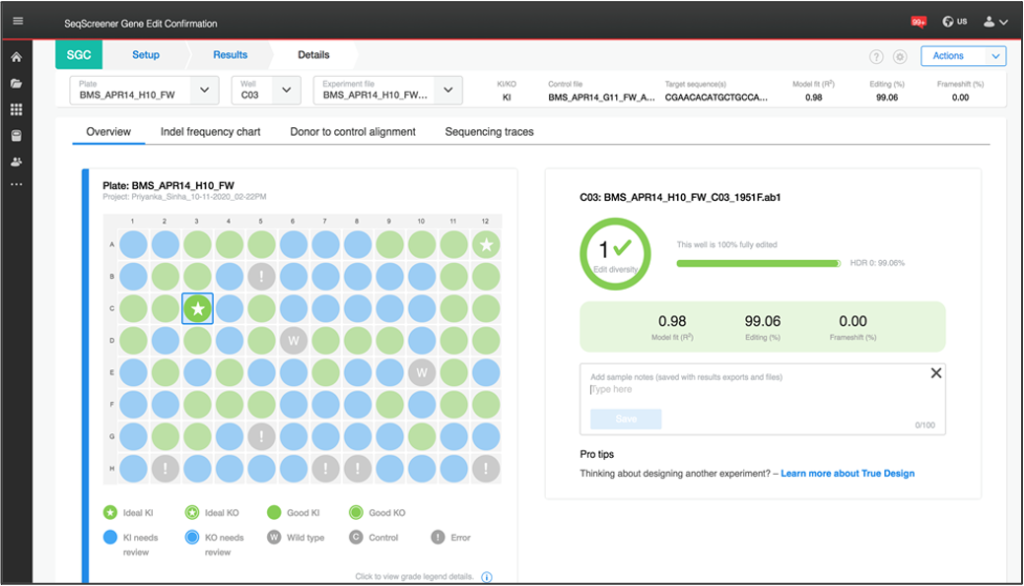
SeqScreener Gene Edit Confirmation Appでは、初代培養細胞、もしくは二次培養細胞における、挿入・欠損の範囲と頻度の両方の検出が可能です。
視覚化
挿入や欠失を一度に可視化できるPlate Viewオプションも備えています。また、細胞集団における編集効率や編集パターンも表示することが可能です。特に、複数のgRNAや細胞の種類、トランスフェクション手法の評価を伴うようなハイスループットな実験に有効です。
編集効率
SeqScreener Gene Edit Confirmation Appは、非相同末端結合によって生じた、挿入・欠損の効率を判定する機能だけでなく、SNPの変更などテンプレートに依存した編集の効率も判定することが可能です。
ハイスループット
最後に、SeqScreener Gene Edit Confirmation Appは最大96サンプルを同時に解析できるよう設計されています。このバッチアップロード機能により、ハイスループットなラボでも解析が容易です。
CRISPR/Cas9とサンガーシーケンスによる遺伝子編集の確認
CRISPRのような遺伝子編集技術は、医療において大きな可能性を秘めており、いくつかの疾患に対し実施可能な治療オプションとして検討され始めたばかりです。この分野への関心が高まる中、研究者が自信を持ってゲノム編集を確認できるツールへの認識が高まることも重要です。サンガーシーケンスにはいくつかの利点があり、高い分離能によってヌクレオチドの変化を検証できる、信頼できる方法の1つです。さらに、SeqScreener Gene Edit Confirmation Appを使用すれば、サンガーシーケンスで得られたデータの解釈は、もはや困難な作業ではなくなるのです。
References
1.Cong, L., et al., Multiplex genome engineering using CRISPR/Cas systems. Science, 2013. 339(6121): p. 819-23.
2.Bengtsson, N.E., et al., Muscle-specific CRISPR/Cas9 dystrophin gene editing ameliorates pathophysiology in a mouse model for Duchenne muscular dystrophy. Nat Commun, 2017. 8: p. 14454.
3.Mancuso, P., et al., CRISPR based editing of SIV proviral DNA in ART treated non-human primates. Nat Commun, 2020. 11(1): p. 6065.
4.Abbott, T.R., et al., Development of CRISPR as an Antiviral Strategy to Combat SARS-CoV-2 and Influenza. Cell, 2020. 181(4): p. 865-876 e12.
5.Vouillot, L., A. Thelie, and N. Pollet, Comparison of T7E1 and surveyor mismatch cleavage assays to detect mutations triggered by engineered nucleases. G3 (Bethesda), 2015. 5(3): p. 407-15.
まとめ
・CRISPRはガイドRNAを切り替えるだけで、さまざまな遺伝子編集への応用が可能。
・ゲノム編集は、編集効率の確認が非常に重要
・SeqScreener Gene Edit Confirmation Appを用いることにより、サンガーシーケンスの波形から、ゲノム編集効率の検証が容易に実施可能
研究用にのみ使用できます。診断用には使用いただけません。



