▼もくじ
はじめに
抗体は、抗原を免疫した動物の血清(ポリクローナル抗体)や腹水、あるいはハイブリドーマ細胞培養上清(モノクローナル抗体)から精製します。精製方法には、大きく分けて3つのレベル、すなわち粗精製程度の方法(Crudeレベルの精製)、抗体クラス(またはアイソタイプ)のレベルで精製する方法(抗体クラスレベルの精製)、目的抗原に特異的な抗体精製を行う方法(Specificな精製)があり、さまざまな方法が利用されています。
今回はそれぞれのレベルごとに精製方法を挙げてその概要をご紹介します!(Specificな精製については次回掲載の予定です)。
Crudeレベルの精製
塩を加えることでタンパク質の溶解度を下げて沈殿させる塩析法がこのレベルの精製に使用されます。塩析で最も広く利用されているのが、塩の中でも溶解度の高い硫酸アンモニウム(以下、硫安)です。硫安により沈殿したタンパク質は変性がほとんど起こらず容易に再溶解できます。また硫安中ではプロテアーゼによる分解や微生物の増殖が起きにくいことが知られています。
硫安を用いた塩析による分画は、硫安沈殿(または硫安分画)と呼ばれています。イムノグロブリンの硫安分画では、一般的に硫安を35-60%飽和の溶液にします。タンパク質溶液に硫安を添加する際は、攪拌しながら少量ずつ添加します(一度に添加すると必要以上の沈殿化を起こしてしまいます)。タンパク質の沈殿を適当なバッファーで溶解した後、透析などで硫安を除きます。
抗体クラスレベルの精製
抗体結合タンパク質を用いた精製
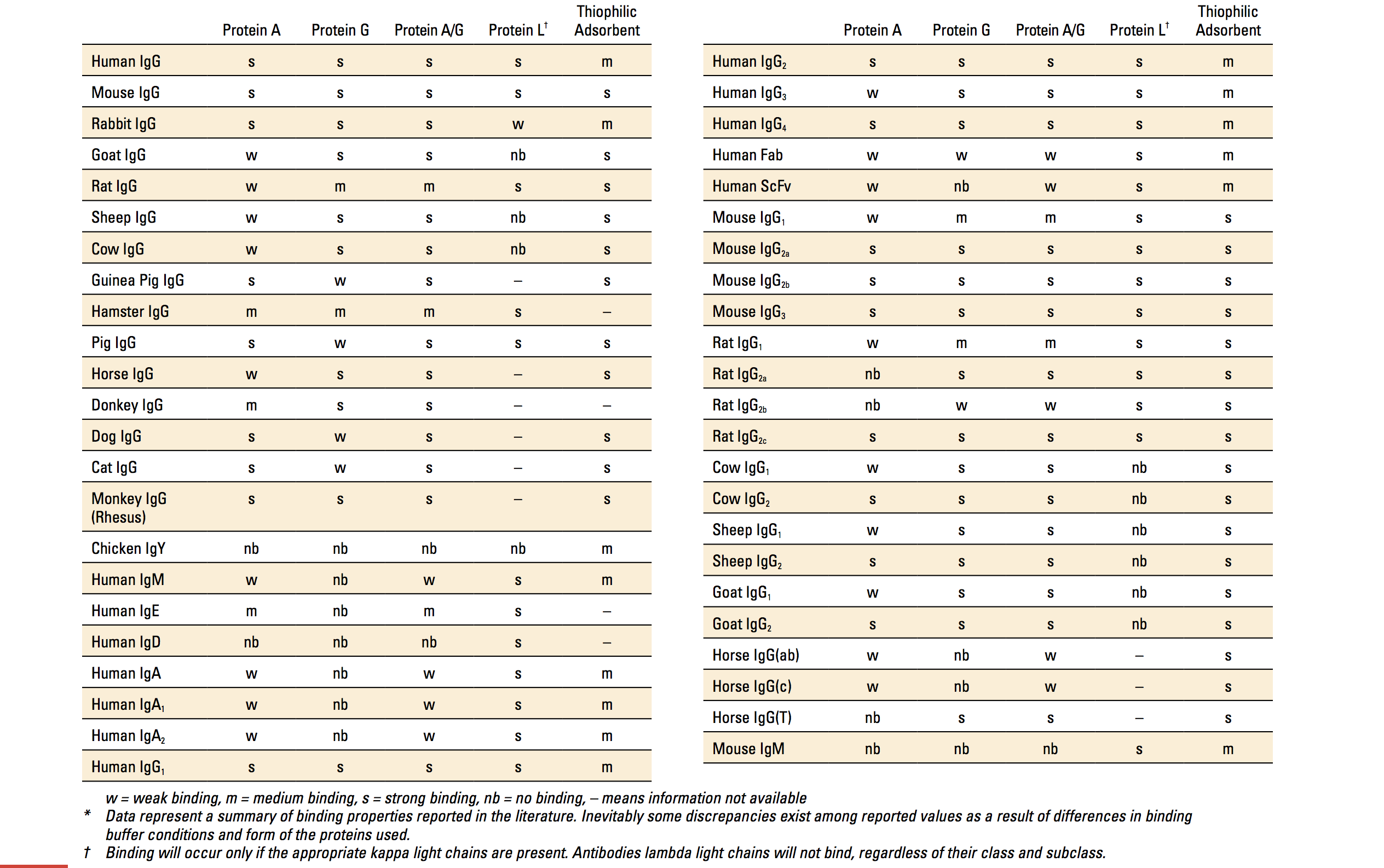
同じ抗体クラスにおいて抗体の構造はよく似ているため、適当なリガンドを用いることで同じクラスの抗体をまとめてアフィニティー精製ができます。細菌中に存在するProtein A、Protein G、Protein Lは、抗体(主にIgG)と特異的に結合する代表的なタンパク質です。これらのタンパク質は、いずれも抗体の抗原結合ドメインとは結合せず、Protein AやProtein Gは抗体のFc領域と結合、Protein Lは抗体の軽鎖(κ軽鎖)と結合します。Protein A、G、Lはそれぞれ抗体の動物種やサブクラスによって結合アフィニティーが異なるため、目的サンプルや目的抗体のタイプから適当な抗体結合タンパク質を選択します。遺伝子工学的手法によりProtein AとProtein Gの抗体結合ドメイン同士を融合したProtein A/Gを用いた場合、Protein A、Gそれぞれ単独の場合に比べて、利用できる抗体タイプの幅が広くなります。
抗体のアフィニティー精製には、通常、これらの抗体結合タンパク質を固定化したアガロースレジン、アクリルアミドレジン、磁性ビーズを使用します。適当な結合バッファーで平衡化した抗体結合タンパク質固定化レジンに抗体を含むサンプル溶液を添加し、洗浄後、溶出バッファーで処理して抗体を精製します。結合の至適pHは各抗体結合タンパク質で異なる(Protein Aの至適pH: 8.2、Protein Gの至適pH: 5、Protein Lの至適pH: 7.5、Protein A/Gの至適pH: 5-8.2)ため、適当なバッファーを選択する必要があります。溶出には、抗体結合タンパク質との結合pHから大きく離れたpH(酸性または塩基性)による溶出、高塩濃度による溶出、界面活性剤などの変性剤による溶出、競合リガンドによる溶出が利用できます。一般的には酸性バッファー(0.1 M glycine-HCl, pH 2-3)による溶出が行われますが、抗体によっては酸による変性や凝集を引き起こしてしまうため注意が必要です。
ネガティブセレクション法による精製
Melon™ Gel IgG Purification Kitは、IgG抗体をネガティブセレクションにより精製するためのレジンゲルです。ゲルには独自のリガンドを固定化しており、血清、腹水、培養上清に含まれるさまざまなタンパク質†を保持することが出来ます。IgGは結合しないため、サンプルをMelon Gelに通過させると素通り画分にIgGが回収(ネガティブセレクション)されます。IgGの典型的な収率は90%以上、精製純度は80%以上です。Protein Aなどの抗体結合タンパク質と異なり、動物種やサブクラスでほとんど制限されず‡、抗体結合タンパク質との結合アフィニティーが弱いIgGの精製にも利用可能です。抗体を変性させるような溶出バッファーを使用する必要が無いため、抗体の活性を保持したまま精製することが可能です。使用済みのゲルは複数回再生・再利用できます。
† トランスフェリン(特にマウスやラット由来)との結合アフィニティーは弱いため、抗体と共に素通り画分に回収されます。あらかじめサンプルを硫安分画することでトランスフェリンを含まない抗体精製が可能です。
‡ チキンIgYの精製には利用できません。チキンIgYの精製にはThiophilic Adsorption KitまたはChicken IgY Purification Kitがおすすめです。
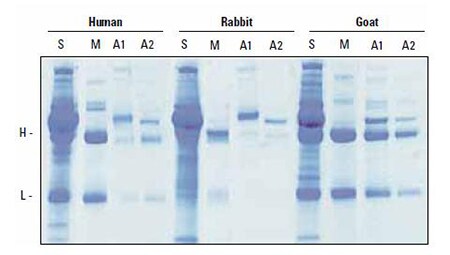
図1 Melon GelまたはProtein A固定化レジンを用いたIgG精製 ヒト、ウサギ、ヤギの各血清サンプルを、それぞれMelon GelまたはProtein A固定化レジンを用いて精製しました。精製後のサンプルをSDS電気泳動により分離しCBB染色(GelCode™ Blue Stain)により検出しました。 S: 血清サンプル、M: Melon Gel素通り画分、A1およびA2: Protein A固定化レジンを用いた溶出画分 H: 抗体重鎖(Heavy chain)、L: 抗体軽鎖(Light chain)
Thiophilic Gelを用いた精製
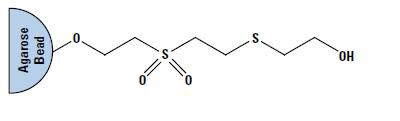
Thiophilic Gel(T-Gelとも呼ばれる)は、スルホン基・チオエーテル基を修飾したゲル(図2)で、非カオトロピック塩の濃度が高いとthiophilicな吸着や疎水的な吸着が起こりやすくなります。特に硫酸カリウムや硫酸アンモニウムの濃度が高い場合にthiophilicな吸着が起こりやすくなり、塩化ナトリウムの濃度が高い場合に疎水的な吸着が起こりやすくなります。thiophilic吸着は、血清、腹水、培養細胞からのイムノグロブリン精製に使用できます。Thiophilic Adsorption Kitでは、0.5Mの硫酸カリウムを含むBinding Buffer(pH 8.0)により主にIgGを結合、低塩濃度のElution Buffer(pH 7.4)により、IgGを精製するためのキットです。thiophilic吸着は、さまざまな動物種やサブクラスのIgG精製に利用でき、チキンIgYの精製にも利用できます。穏やかな条件で溶出するため、抗体の活性を保持したまま精製することが可能です。使用済みのゲルは複数回再生・再利用できます。
マンナン結合タンパク質を用いたIgM精製
マンナン結合タンパク質(mannan binding protein: MBP)はマンノースやN-アセチルグルコサミンに特異的に結合するレクチンタンパク質です。Pierce™ IgM Purification Kitは、IgMの精製に至適化したMBP固定化レジンと各種バッファーを含むキットです。IgMの結合は温度およびカルシウム濃度依存的に起こります。結合バッファーには20 mMの塩化カルシウムを含むTris-HClバッファー(pH 7.4)を用いて、MBP固定化レジンにIgMを4℃で結合させます。溶出バッファーには結合バッファーから塩化カルシウムを除き代わりにEDTAを添加したバッファーを用いて、室温で溶出します。穏やかな条件で溶出するため、抗体の活性を保持したまま精製することが可能です。Pierce™ IgM Purification Kitは、特にマウス腹水からのIgM精製に適しており、90%以上の純度で精製可能です。使用済みのゲルは複数回再生・再利用できます。
ジャカリンを用いたIgA精製
ジャカリンは、ジャックフルーツの種から抽出されるα-D-galactose結合性レクチンタンパク質です。ジャカリンは、血清中のヒトIgA1や分泌型ヒトIgA1に特異的に結合することが知られています。ジャカリンとIgAとの結合はPBS(phosphate buffered saline)の様な生理的バッファー条件下で起こります。IgAの溶出には競合リガンド(例: 0.1M melibioseや0.1M α-D-galactose)を含むPBSを使用します。弊社では、6%アガロースにジャカリンを固定化したImmobilized Jacalinをご用意しています。
最後に
いかがでしたでしょうか?
今回紹介しました抗体クラスレベルの精製法は、最も広く利用されている抗体精製法です。Crudeレベルの精製法と組合せることで、さらに精製純度を上げることが可能です。まとめの意味をこめて、表2に抗体クラスレベルの精製法を掲載しておきます。
| 精製方法/ターゲットクラス | 原理 | 弊社製品例 |
| ネガティブセレクション | 血清、腹水、培養上清中のタンパク質を結合するMelon Gelによる精製 | Melon™ Gel IgG Purification Kit |
| IgGの精製 | 抗体結合タンパク質を利用した精製 | NAb™ Protein A Plus Spin Kit |
| NAb™ Protein G Spin Kit | ||
| NAb™ Protein A/G Spin Kit | ||
| NAb™ Protein L Spin Kit | ||
| IgG(IgY)の精製 | Thiophilic吸着を利用した精製 | Pierce™ Thiophilic Adsorption Kit |
| IgMの精製 | マンナン結合タンパク質を利用した精製 | Pierce™ IgM Purification Kit |
| IgAの精製 | ジャカリンを利用した精製 | Pierce™ Jacalin Agarose |
| IgYの精製 | 卵白からの脱脂および沈殿による精製 | Pierce™ Chicken IgY Purification Kit |
次回は、目的抗原に特異的な抗体精製を行う方法(Specificな精製)を紹介します!
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。
共免疫沈降法関連、その他の記事はこちら
研究用にのみ使用できます。診断用には使用いただけません。