õ╗ŖÕø×Ńü»ŃĆüńøĖõ║ÆõĮ£ńö©Ķ¦Żµ×ÉŃü«õ╗ŻĶĪ©ńÜäŃü¬µēŗµ│ĢŃü¦ŃüéŃéŗÕģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü½ŃüżŃüäŃü”ŃĆüŃüØŃü«ÕĢÅķĪīńé╣Ńü©µö╣Õ¢äńŁ¢ŃéÆń┤╣õ╗ŗŃüŚŃüŠŃüÖ’╝ü
Ō¢╝ŃééŃüÅŃüś
Ńü»ŃüśŃéüŃü½
ń¼¼8Õø×Ńü¦ń░ĪÕŹśŃü½Ķ¬¼µśÄŃüŚŃü¤Õģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü«ÕĤńÉåŃéÆŃüŖŃüĢŃéēŃüäŃüŚŃü”ŃüŖŃüŹŃüŠŃüÖŃĆé
[ss url=”https://www.thermofisher.com/blog/learning-at-the-bench/protein-basic8/” width=”180″ class=”alignleft” alt=”ń¤źŃüŻŃü”ŃüŖŃüŹŃü¤Ńüä’╝üŃé┐Ńā│ŃāæŃé»Ķ│¬Õ«¤ķ©ōŃüéŃéīŃüōŃéī ń¼¼8Õø×” rel=”nofollow” ext=0 title=”ń¤źŃüŻŃü”ŃüŖŃüŹŃü¤Ńüä’╝üŃé┐Ńā│ŃāæŃé»Ķ│¬Õ«¤ķ©ōŃüéŃéīŃüōŃéī ń¼¼8Õø× in vitro Ńé┐Ńā│ŃāæŃé»Ķ│¬ńøĖõ║ÆõĮ£ńö©ŃéÆĶ¦Żµ×ÉŃüÖŃéŗµ¢╣µ│ĢŃüŠŃü©Ńéü” caption=”Ńé┐Ńā│ŃāæŃé»Ķ│¬ńøĖõ║ÆõĮ£ńö©Ķ¦Żµ×ɵ│ĢŃü½Ńü»ÕżÜŃüÅŃü«µēŗµ│ĢŃüīķ¢ŗńÖ║ŃüĢŃéīŃü”ŃüäŃüŠŃüÖŃĆéõ╗ŖÕø×Ńü»ŃĆüÕåŹńÅŠµĆ¦Ńüīµ»öĶ╝āńÜäķ½śŃüÅŃéłŃéŖńø┤µÄźńÜäŃü¬ńøĖõ║ÆõĮ£ńö©Ķ¦Żµ×ÉŃéÆĶĪīŃüåŃüōŃü©ŃüīŃü¦ŃüŹŃéŗin vitro Ńé┐Ńā│ŃāæŃé»Ķ│¬ńøĖõ║ÆõĮ£ńö©Ķ¦Żµ×ɵ│ĢŃü½ŃüżŃüäŃü”ŃüŠŃü©ŃéüŃü”Ńü┐ŃüŠŃüŚŃü¤ŃĆé” ]
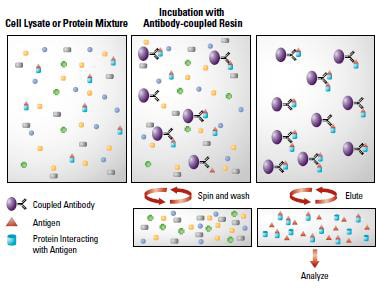
Õģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü»ŃĆüŃéĄŃā│ŃāŚŃā½’╝łõŠŗŃüłŃü░ń┤░Ķā×Ńā®ŃéżŃé╗Ńā╝Ńāł’╝ēõĖŁŃü½ÕŁśÕ£©ŃüÖŃéŗĶżćÕÉłõĮōŃéÆŃĆüµŖŚõĮōŃéÆÕł®ńö©ŃüŚŃü”Õø×ÕÅÄŃüÖŃéŗµēŗµ│ĢŃü¦ŃüÖŃĆéÕÅżÕģĖńÜäŃü¬Õģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü¦Ńü»ÕģłŃüÜŃĆüĶżćÕÉłõĮōŃéÆÕĮóµłÉŃüÖŃéŗÕłåÕŁÉŃü«ÕåģŃü«1ŃüżŃü«ÕłåÕŁÉŃü½Õ»ŠŃüÖŃéŗµŖŚõĮōŃéÆŃéĄŃā│ŃāŚŃā½Ńü½µĘ╗ÕŖĀŃüŚŃĆüµŖŚõĮōŃü©µ©ÖńÜäĶżćÕÉłõĮōŃü©ŃéÆÕÅŹÕ┐£ŃüĢŃüøŃüŠŃüÖŃĆéµ¼ĪŃü½µŖŚõĮōŃü©ÕÅŹÕ┐£ŃüÖŃéŗŃé┐Ńā│ŃāæŃé»Ķ│¬’╝łProtein AŃéäProtein GŃü¬Ńü®’╝ēŃéÆÕø║Õ«ÜÕī¢ŃüŚŃü¤µö»µīüõĮō’╝łŃéóŃé¼ŃāŁŃā╝Ńé╣µŗģõĮōŃü¬Ńü®’╝ēŃéÆÕÅŹÕ┐£ŃüĢŃüøŃéŗŃüōŃü©Ńü¦ŃĆüµö»µīüõĮōŃü½µ©ÖńÜäĶżćÕÉłõĮōŃéƵŹĢµŹēŃüŚŃüŠŃüÖ’╝łÕø│’╝ēŃĆéÕÅŹÕ┐£µ║ȵČ▓ŃéÆķüĀÕ┐āŃüŚŃü”µ©ÖńÜäĶżćÕÉłõĮōŃéƵö»µīüõĮōŃü©Ńü©ŃééŃü½µ▓łµ«┐ŃüĢŃüøŃü¤ÕŠīŃĆüķü®ÕĮōŃü¬ŃāÉŃāāŃāĢŃéĪŃā╝Ńü¦µ┤ŚµĄäŃüŚŃĆüŃüĢŃéēŃü½µö»µīüõĮōŃüŗŃéēµŖŚõĮōŃü©µ©ÖńÜäĶżćÕÉłõĮōŃéÆĶ¦ŻķøóŃüĢŃüøŃéŗŃü¤ŃéüŃü½ķü®ÕĮōŃü¬ŃāÉŃāāŃāĢŃéĪŃā╝Ńü¦Õć”ńÉåŃüŚŃü”µŖŚõĮōŃüŖŃéłŃü│µ©ÖńÜäĶżćÕÉłõĮōŃéƵ║ČÕć║ŃüŚŃüŠŃüÖŃĆéÕģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü»ŃĆüńø«ńÜäµŖŚÕĤŃü©ĶżćÕÉłõĮōŃéÆÕĮóµłÉŃüÖŃéŗÕłåÕŁÉŃü©Ńü«ń┤░Ķā×Ńā¼ŃāÖŃā½Ńü½ŃüŖŃüæŃéŗńøĖõ║ÆõĮ£ńö©Ńü«Ķ¦Żµ×ɵēŗµ│ĢŃü©ŃüŚŃü”ÕÅżŃüÅŃüŗŃéēÕł®ńö©ŃüĢŃéīŃü”ŃüäŃüŠŃüÖŃĆé
ÕŠōµØźŃü«Õģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü½ŃüŖŃüæŃéŗÕĢÅķĪīńé╣
µŖŚõĮōŃāĢŃā®Ńé░ŃāĪŃā│ŃāłŃü½ŃéłŃéŗµż£Õć║ķś╗Õ«│
Õģ▒ÕģŹń¢½µ▓łķÖŹµ│Ģ’╝łŃüŠŃü¤Ńü»ÕģŹń¢½µ▓łķÖŹµ│Ģ’╝ēŃü¦Ńü»ŃĆüń▓ŠĶŻĮŃüŚŃü¤µ©ÖńÜäĶżćÕÉłõĮōŃéÆSDS-PAGEŃéäŃé”Ńé¦Ńé╣Ńé┐Ńā│Ńā¢ŃāŁŃāāŃāåŃéŻŃā│Ńé░Ńü¦Ķ¦Żµ×ÉŃüÖŃéŗŃü«ŃüīõĖĆĶł¼ńÜäŃü¦ŃüÖŃĆéŃüōŃü«Ķ¦Żµ×ÉŃü«ķÜøŃü½µ£ĆŃééÕĢÅķĪīŃü½Ńü¬ŃéŗŃü«ŃüīŃĆüÕģŹń¢½µ▓łķÖŹŃü½Õł®ńö©ŃüŚŃü¤µŖŚõĮōŃüīÕĮ▒ķ¤┐ŃüŚŃü”ńø«ńÜäŃé┐Ńā│ŃāæŃé»Ķ│¬Ńü«µż£Õć║Ńüīķś╗Õ«│ŃüĢŃéīŃéŗŃüōŃü©Ńü¦ŃüÖŃĆéÕģŹń¢½µ▓łķÖŹŃü¦ńö©ŃüäŃéŗµŖŚõĮō’╝łķĆÜÕĖĖIgG’╝ēŃü»ŃĆüķéäÕģāSDS-PAGEŃü½ŃéłŃéŖÕłåķøóŃüÖŃéŗŃü©ķćŹķÄ¢Ńü©Ķ╗ĮķÄ¢Ńü«ÕÉäŃāĢŃā®Ńé░ŃāĪŃā│ŃāłŃü½ÕłåķøóŃüĢŃéīŃĆüŃüØŃéīŃü×Ńéī50 kDaŃü©25 kDaŃü«õĮŹńĮ«Ńü½ŃāÉŃā│ŃāēŃüīµż£Õć║ŃüĢŃéīŃüŠŃüÖŃĆéŃüŚŃü¤ŃüīŃüŻŃü”µ©ÖńÜäĶżćÕÉłõĮōŃéÆÕĮóµłÉŃüÖŃéŗŃé┐Ńā│ŃāæŃé»Ķ│¬Ńüīķø╗µ░Śµ││ÕŗĢÕŠīŃüōŃü«ŃéĄŃéżŃé║õ╗śĶ┐æŃü½ÕłåķøóŃüĢŃéīŃéŗŃü©ŃĆüµŖŚõĮōŃāĢŃā®Ńé░ŃāĪŃā│ŃāłŃü©ŃāÉŃā│ŃāēŃüīķćŹŃü¬ŃüŻŃü”ŃüŚŃüŠŃüäŃüŠŃüÖŃĆéŃé”Ńé¦Ńé╣Ńé┐Ńā│Ńā¢ŃāŁŃāāŃāåŃéŻŃā│Ńé░Ńü½ŃüŖŃüäŃü”Ńééõ║īµ¼ĪµŖŚõĮōŃüīÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéÆĶ¬ŹĶŁśŃüÖŃéŗŃü©ńø«ńÜäŃé┐Ńā│ŃāæŃé»Ķ│¬Ńü«ńē╣ńĢ░ńÜäŃü¬µż£Õć║ŃüīÕø░ķøŻŃü½Ńü¬ŃüŻŃü”ŃüŚŃüŠŃüäŃüŠŃüÖŃĆé
ÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃü«õĖŹµ┤╗µĆ¦Õī¢
ķüĀÕ┐āŃāÜŃā¼ŃāāŃāłŃü©ŃüŚŃü”Õø×ÕÅÄŃüŚŃü¤µ©ÖńÜäĶżćÕÉłõĮōŃü«µ║ČÕć║Ńü½Ńü»ŃĆüõĖĆĶł¼ńÜäŃü½ķģĖŃéäÕżēµĆ¦ÕēżŃéÆÕɽŃéĆŃāÉŃāāŃāĢŃéĪŃā╝ŃéÆÕł®ńö©ŃüŚŃüŠŃüÖŃĆéŃüōŃü«Ńü¤Ńéüµö»µīüõĮōŃüŗŃéēÕłåķøóŃüŚŃü¤µŖŚõĮōŃü»ÕåŹÕł®ńö©Ńü½ÕÉæŃüŗŃüÜŃĆüµ»ÄÕø×µ¢░ŃüŚŃüäµŖŚõĮōŃéÆńö©ŃüäŃü¤Õģ▒ÕģŹń¢½µ▓łķÖŹÕ«¤ķ©ōŃüīÕ┐ģĶ”üŃü½Ńü¬ŃéŖŃüŠŃüÖŃĆé
ķØ×ńē╣ńĢ░Ńé┐Ńā│ŃāæŃé»Ķ│¬Ńü«Ńé│Ńā│Ńé┐Ńā¤ŃāŹŃā╝ŃéĘŃā¦Ńā│Ńü©ŃéĄŃā│ŃāŚŃā½ŃāŁŃé╣
ŃĆīŃü»ŃüśŃéüŃü½ŃĆŹŃü«ķĀģŃü¦Ķ¬¼µśÄŃüŚŃü¤ŃéłŃüåŃü½ŃĆüÕŠōµØźŃü«Õģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü¦Ńü»µŖŚõĮōŃéƵ©ÖńÜäĶżćÕÉłõĮōŃü©ÕÅŹÕ┐£ŃüĢŃüøŃü¤ÕŠīŃĆüµö»µīüõĮōŃü½ńĄÉÕÉłŃüĢŃüøŃĆüķüĀÕ┐āµōŹõĮ£Ńü½ŃéłŃüŻŃü”ŃāÜŃā¼ŃāāŃāłŃü½Õø×ÕÅÄŃüŚŃüŠŃüÖŃĆéŃüōŃü«ŃéłŃüåŃü¬ŃāÉŃāāŃāüµ│ĢŃü¦Ńü»µ┤ŚµĄäÕŖ╣ńÄćŃüīµé¬ŃüÅŃü¬ŃéŗÕéŠÕÉæŃü½ŃüéŃéŖŃĆüµ║ČÕć║ńö╗ÕłåŃüĖŃü«ķØ×ńē╣ńĢ░Ńé┐Ńā│ŃāæŃé»Ķ│¬Ńü«Ńé│Ńā│Ńé┐Ńā¤ŃāŹŃā╝ŃéĘŃā¦Ńā│Ńü«ÕĤÕøĀŃü©Ńü¬ŃüŻŃü”ŃüŚŃüŠŃüäŃüŠŃüÖŃĆéŃüŠŃü¤ŃāÉŃāāŃāüµ│ĢŃü¦Ńü»µ┤ŚµĄäµČ▓Ńü«ķÖżÕÄ╗ŃéÆŃāćŃé½Ńā│ŃāåŃā╝ŃéĘŃā¦Ńā│ŃéäŃāöŃāÜŃāāŃāłµōŹõĮ£Ńü½ŃéłŃüŻŃü”ĶĪīŃüåŃü¤ŃéüŃĆüĶ¬żŃüŻŃü”ŃéĄŃā│ŃāŚŃā½ŃéƵŹ©Ńü”Ńü”ŃüŚŃüŠŃüåÕĀ┤ÕÉłŃüīŃüéŃéŖŃüŠŃüÖŃĆé
Õģ▒ÕģŹń¢½µ▓łķÖŹµ│ĢŃü«ÕĢÅķĪīńé╣ŃéƵö╣Õ¢äŃüÖŃéŗŃü¤ŃéüŃü«ŃéóŃāŚŃāŁŃā╝Ńāü
µż£Õć║ķś╗Õ«│ŃéÆĶ¦ŻµČłŃüÖŃéŗŃü¤ŃéüŃü«ŃéóŃāŚŃāŁŃā╝Ńāü
µŖŚõĮōŃāĢŃā®Ńé░ŃāĪŃā│ŃāłŃü½ŃéłŃéŗµż£Õć║ķś╗Õ«│ŃéÆĶ¦ŻµČłŃüÖŃéŗŃü¤ŃéüŃü½Ńü»ŃĆüµŖŚõĮōŃāĢŃā®Ńé░ŃāĪŃā│ŃāłŃü«Õģ▒µ║ČÕć║ŃéƵŖæŃüłŃéŗŃéóŃāŚŃāŁŃā╝ŃāüŃüīµ£ēÕŖ╣Ńü¦ŃüÖŃĆéŃüōŃü«ŃéóŃāŚŃāŁŃā╝ŃāüŃü½Ńü»ŃĆüÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéƵö»µīüõĮōŃü½Õģ▒µ£ēńĄÉÕÉłńÜäŃü½Õø║Õ«ÜÕī¢ŃüÖŃéŗµ¢╣µ│ĢŃüéŃéŗŃüäŃü»ŃéóŃāōŃéĖŃā│ŌĆÉŃāōŃé¬ŃāüŃā│ķ¢ōŃü«Õ╝ĘÕŖøŃü¬ŃéóŃāĢŃéŻŃāŗŃāåŃéŻŃā╝ńøĖõ║ÆõĮ£ńö©ŃéÆÕł®ńö©ŃüÖŃéŗµ¢╣µ│ĢŃüīµīÖŃüÆŃéēŃéīŃüŠŃüÖŃĆé ÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéƵö»µīüõĮōŃü½Õģ▒µ£ēńĄÉÕÉłÕø║Õ«ÜŃüÖŃéŗµ¢╣µ│ĢŃü½Ńü»ŃĆü2ŃüżŃü«µ¢╣µ│ĢŃüīõĮ┐ńö©Ńü¦ŃüŹŃüŠŃüÖŃĆé1ŃüżŃéüŃü«µ¢╣µ│ĢŃü»ŃĆüµŖŚõĮōńĄÉÕÉłŃé┐Ńā│ŃāæŃé»Ķ│¬’╝łProtein AŃéäProtein G’╝ēŃéÆÕø║Õ«ÜÕī¢ŃüŚŃü¤µö»µīüõĮōŃü½ÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéÆÕÅŹÕ┐£ŃüĢŃüøŃü¤ÕŠīŃĆüŃé»ŃāŁŃé╣Ńā¬Ńā│Ńé½Ńā╝Ńü½ŃéłŃüŻŃü”Õģ▒µ£ēńĄÉÕÉłńÜäŃü½Õø║Õ«ÜÕī¢ŃüÖŃéŗµ¢╣µ│ĢŃü¦ŃüÖŃĆéŃééŃüå1ŃüżŃü«µ¢╣µ│ĢŃü»ŃĆüµŖŚõĮōõĖŁŃü«ÕÅŹÕ┐£Õ¤║’╝łŃéóŃā¤ŃāÄÕ¤║Ńü¬Ńü®’╝ēŃü©ÕÅŹÕ┐£ŃüÖŃéŗµ┤╗µĆ¦Õī¢µŗģõĮōŃéÆÕł®ńö©ŃüŚŃü”µŖŚõĮōŃéÆńø┤µÄźµö»µīüõĮōŃü½Õģ▒µ£ēńĄÉÕÉłŃüĢŃüøŃéŗµ¢╣µ│ĢŃü¦ŃüÖŃĆéõĖŖĶ©śŃü«ŃüäŃüÜŃéīŃü«µ¢╣µ│ĢŃü¦ŃééÕø║Õ«ÜÕī¢ŃüĢŃéīŃü¬ŃüŗŃüŻŃü¤µŖŚõĮōŃü»Õģ▒ÕģŹń¢½µ▓łķÖŹÕēŹŃü½µ┤ŚµĄäķÖżÕÄ╗Ńü¦ŃüŹŃüŠŃüÖŃĆé ŃéóŃāōŃéĖŃā│ŌĆÉŃāōŃé¬ŃāüŃā│ķ¢ōŃü«Õ╝ĘÕŖøŃü¬ŃéóŃāĢŃéŻŃāŗŃāåŃéŻŃā╝ńøĖõ║ÆõĮ£ńö©ŃéÆÕł®ńö©ŃüÖŃéŗµ¢╣µ│ĢŃü¦Ńü»ŃĆüŃāōŃé¬ŃāüŃā│µ©ÖĶŁśŃüŚŃü¤ÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéÆŃéóŃāōŃéĖŃā│ŃéäŃé╣ŃāłŃā¼ŃāŚŃāłŃéóŃāōŃéĖŃā│µŗģõĮōŃü½Õø║Õ«ÜÕī¢ŃüÖŃéŗŃüōŃü©Ńü½ŃéłŃéŖŃĆüµŖŚõĮōŃü«Õģ▒µ║ČÕć║ŃéƵŖæŃüłŃéŗŃüōŃü©ŃüīÕÅ»ĶāĮŃü½Ńü¬ŃéŖŃüŠŃüÖŃĆé
ÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃü«õĖŹµ┤╗µĆ¦Õī¢ŃéƵŖæŃüłŃéŗŃü¤ŃéüŃü«ŃéóŃāŚŃāŁŃā╝Ńāü
ķüĀÕ┐āŃāÜŃā¼ŃāāŃāłŃü©ŃüŚŃü”Õø×ÕÅÄŃüŚŃü¤µ©ÖńÜäĶżćÕÉłõĮōŃü«µ║ČÕć║Ńü½Ńā×ŃéżŃā½ŃāēŃü¬ŃāÉŃāāŃāĢŃéĪŃā╝ŃéÆÕł®ńö©ŃüÖŃéŗŃüōŃü©Ńü¦ŃĆüÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃü«õĖŹµ┤╗µĆ¦Õī¢ŃéÆķü┐ŃüæŃéŗŃüōŃü©ŃüīÕÅ»ĶāĮŃü¦ŃüÖŃĆéÕ╝ŖńżŠŃü¦Ńü»ŃĆüµŖŚõĮōŃéƵö»µīüõĮōŃü½Õģ▒µ£ēńĄÉÕÉłńÜäŃü½Õø║Õ«ÜÕī¢ŃüÖŃéŗµ¢╣µ│ĢŃéÆÕł®ńö©ŃüŚŃü¤Õģ▒ÕģŹń¢½µ▓łķÖŹŃéŁŃāāŃāłŃéÆŃā®ŃéżŃā│ŃéóŃāāŃāŚŃüŚŃü”ŃüäŃüŠŃüÖŃĆéŃüōŃü«ŃéŁŃāāŃāłŃü½Ńü»ŃĆüŃā×ŃéżŃā½ŃāēŃü¬µØĪõ╗ČŃü¦µŖŚÕĤµ║ČÕć║ŃéÆĶĪīŃüåŃüōŃü©ŃüīÕć║µØźŃéŗÕ░éńö©Ńü«Elution BufferŃéƵĘ╗õ╗śŃüŚŃü”ŃüäŃüŠŃüÖŃĆéŃüōŃü«µ¢╣µ│ĢŃü¦µ║ČÕć║Õć”ńÉåŃüŚŃü¤ÕĀ┤ÕÉłŃĆüµŖŚõĮōÕø║Õ«ÜÕī¢µö»µīüõĮōŃü»ĶżćµĢ░Õø×ÕåŹÕł®ńö©ŃüÖŃéŗŃüōŃü©ŃüīÕÅ»ĶāĮŃü¦ŃüÖŃĆé
Ńé│Ńā│Ńé┐Ńā¤ŃāŹŃā╝ŃéĘŃā¦Ńā│Ńü©ŃéĄŃā│ŃāŚŃā½ŃāŁŃé╣ŃéƵŖæŃüłŃéŗŃü¤ŃéüŃü«ŃéóŃāŚŃāŁŃā╝Ńāü
Õ╝ŖńżŠŃü«Õģ▒ÕģŹń¢½µ▓łķÖŹŃéŁŃāāŃāłŃü¦Ńü»ŃĆüµŖŚõĮōŃéƵö»µīüõĮōŃü½Õģ▒µ£ēńĄÉÕÉłńÜäŃü½Õø║Õ«ÜÕī¢ŃüŚŃü¤ÕŠīŃü«Õģ©Ńü”Ńü«µōŹõĮ£’╝łµ©ÖńÜäĶżćÕÉłõĮōŃü©Ńü«ÕÅŹÕ┐£ŃĆüµ┤ŚµĄäŃĆüµ║ČÕć║’╝ēŃéÆŃĆüŃé╣ŃāöŃā│Ńé½Ńā®ŃāĀŃéÆńö©ŃüäŃü”ĶĪīŃüäŃüŠŃüÖŃĆéŃé╣ŃāöŃā│Ńé½Ńā®ŃāĀŃéÆÕł®ńö©ŃüŚŃü¤ÕĀ┤ÕÉłŃĆüµ┤ŚµĄäÕŖ╣ńÄćŃéäµŖŚÕĤŃü«µ║ČÕć║ÕŖ╣ńÄćŃüīÕÉæõĖŖŃüŚŃĆüŃüéŃéäŃüŠŃüŻŃü”ŃéĄŃā│ŃāŚŃā½ŃéÆķÖżÕÄ╗ŃüŚŃü”ŃüŚŃüŠŃüåŃüōŃü©ŃüīŃüéŃéŖŃüŠŃüøŃéōŃĆé
µ£ĆÕŠīŃü½
Õģ▒ÕģŹń¢½µ▓łķÖŹµ│Ģ’╝łŃüŠŃü¤Ńü»ÕģŹń¢½µ▓łķÖŹµ│Ģ’╝ēŃü¦µ£ĆŃééÕĢÅķĪīŃü½Ńü¬ŃéŗŃü«ŃüīŃĆüÕģŹń¢½µ▓łķÖŹŃü½Õł®ńö©ŃüŚŃü¤µŖŚõĮōŃüīÕĮ▒ķ¤┐ŃüŚŃü”ńø«ńÜäŃé┐Ńā│ŃāæŃé»Ķ│¬Ńü«µż£Õć║Ńüīķś╗Õ«│ŃüĢŃéīŃéŗŃüōŃü©Ńü¦ŃüÖŃĆéõ╗ŖÕø×Ńü»ŃĆüÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéƵö»µīüõĮōŃü½Õģ▒µ£ēńĄÉÕÉłńÜäŃü½Õø║Õ«ÜÕī¢ŃüÖŃéŗµ¢╣µ│ĢŃü©ŃéóŃāōŃéĖŃā│ŌĆÉŃāōŃé¬ŃāüŃā│ķ¢ōŃü«ŃéóŃāĢŃéŻŃāŗŃāåŃéŻŃā╝ńøĖõ║ÆõĮ£ńö©ŃéÆÕł®ńö©ŃüÖŃéŗµ¢╣µ│ĢŃéÆń┤╣õ╗ŗŃüŚŃüŠŃüŚŃü¤ŃüīŃĆüŃüōŃéīŃéēŃü«µ¢╣µ│ĢŃüīÕł®ńö©Ńü¦ŃüŹŃü¬ŃüäÕĀ┤ÕÉłŃéäŃĆüÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃü«µ║ČÕć║Ńüīķü┐ŃüæŃéēŃéīŃü¬ŃüäÕĀ┤ÕÉłŃü½Ńü»ŃĆüŃé”Ńé¦Ńé╣Ńé┐Ńā│Ńā¢ŃāŁŃāāŃāåŃéŻŃā│Ńé░Ńü½ŃüŖŃüäŃü”ÕģŹń¢½µ▓łķÖŹµŖŚõĮōŃéƵż£Õć║ŃüŚŃü¬Ńüäµ¢╣µ│ĢŃüīķüĖµŖ×Ńü¦ŃüŹŃüŠŃüÖŃĆéÕ╝ŖńżŠŃü¦Ńü»ŃĆüÕżēµĆ¦ŃüŚŃü¤µŖŚõĮō’╝łÕģŹń¢½µ▓łķÖŹµŖŚõĮō’╝ēŃü©Ńü»ÕÅŹÕ┐£ŃüøŃüÜŃĆüŃāŹŃéżŃāåŃéŻŃā¢Ńü¬õĖƵ¼ĪµŖŚõĮōŃéÆĶ¬ŹĶŁśŃüÖŃéŗķģĄń┤Āµ©ÖĶŁśĶ®”Ķ¢¼ŃĆüClean-Blot IP Detection ReagentŃéÆŃüöńö©µäÅŃüŚŃü”ŃüäŃüŠŃüÖŃĆé
ŃĆÉńäĪµ¢ÖŃāĆŃé”Ńā│ŃāŁŃā╝ŃāēŃĆæŃé┐Ńā│ŃāæŃé»Ķ│¬Ķ¦Żµ×ÉŃā»Ńā╝Ńé»ŃāĢŃāŁŃā╝ŃāÅŃā│ŃāēŃā¢ŃāāŃé»
ÕŖ╣ńÄćńÜäŃü¬Ńé┐Ńā│ŃāæŃé»Ķ│¬µŖĮÕć║ŃüŗŃéēŃé”Ńé¦Ńé╣Ńé┐Ńā│Ńā¢ŃāŁŃāāŃāåŃéŻŃā│Ńé░Ńü«Ķ¦Żµ×ÉŃāäŃā╝Ńā½ŃüŠŃü¦ŃĆüÕīģµŗ¼ńÜäŃü½ŃéĮŃā¬ŃāźŃā╝ŃéĘŃā¦Ńā│ŃéÆń┤╣õ╗ŗŃüŚŃü”ŃüŖŃéŖŃüŠŃüÖŃĆéPDFŃāĢŃéĪŃéżŃā½Ńü«ŃāĆŃé”Ńā│ŃāŁŃā╝ŃāēŃéÆŃüöÕĖīµ£øŃü«µ¢╣Ńü»ŃĆüõĖŗĶ©śŃā£Ńé┐Ńā│ŃéłŃéŖŃüŖńö│ĶŠ╝Ńü┐ŃüÅŃüĀŃüĢŃüäŃĆé
Õģ▒ÕģŹń¢½µ▓łķÖŹµ│Ģķ¢óķĆŻŃĆüŃüØŃü«õ╗¢Ńü«Ķ©śõ║ŗŃü»ŃüōŃüĪŃéē
ńĀöń®Čńö©Ńü½Ńü«Ńü┐õĮ┐ńö©Ńü¦ŃüŹŃüŠŃüÖŃĆéĶ©║µ¢Łńö©Ńü½Ńü»õĮ┐ńö©ŃüäŃü¤ŃüĀŃüæŃüŠŃüøŃéōŃĆé