ウェスタンブロッティングは何百種類ものタンパク質が含まれているサンプルから、目的とする1つのタンパク質だけを検出できるという意味でとても強力なツールです。ウェスタンブロッティングもしくはイムノブロッティングは、Towbinらが1979年に論文発表 1して以来、40年以上にわたり実験に利用されてきました。初期のウェスタンブロッティングは、標的のタンパク質が「ある」か「ない」かという定性的な情報を提供していました。しかし近年、試薬性能や検出機器の性能が向上したため、定量的な議論に耐えうるデータの取得が可能になりました。このため、研究者はタンパク質の発現量や存在量について、相対的な違いや変化をより正確に測定できるようになってきました。
ウェスタンブロッティングにおける定量的な解析へのシフトに伴い、主要な雑誌や学会、研究助成機関などでは、論文発表におけるデータの整合性をより高い水準に保とうとする動きが出てきています。ウェスタンブロッティングの画像についての最新のガイドラインでは、生成AIや画像編集ソフトウエアの高性能化に伴い、意図的もしくは偶発的なデータ操作に対する防止策が提案されています。
では、この分野のトップジャーナルにとって”出版可能な”ウェスタンブロッティングとはどんなことを意味し、研究者がこれを達成するためにはどんなツールや製品が存在するのでしょうか?このブログでは、”出版可能な”ウェスタンブロッティングのデータを準備するためのお役立ち情報をお届けします。論文としての掲載に適したウェスタンブロッティングのデータ取得のためには、総タンパク質によるノーマライゼーションや、高品質な画像の提出がキーポイントとなっています。
今回のブログは、弊社の英語版ブログサイト”Life in the Lab”で公開されている下記の記事を参考にしたものです。
2024 Guide to Quantitative Western Blot Publication 2
▼もくじ [非表示]
定量ウェスタンブロッティングには必須なノーマライゼーション
定量ウェスタンブロッティングの登場により、タンパク質の相対的な発現比較のデータを取得し、生命現象に関する貴重な洞察を得られるようになりました。定量ウェスタンブロッティングでは、不均一性に関して特に慎重に解釈する必要があります。具体的には、サンプルのタンパク質濃度、ゲルへのローディング、メンブレンへの転写などで不均一性が最も頻繁に発生し、ウェスタンブロッティングにおけるデータのばらつきの原因となります。そこで、 実際の生命現象を反映したタンパク質の発現変化と、実験によるばらつきを区別するために、ノーマライゼーションが必要となります。適切なノーマライゼーションを利用することで、実験結果の正確性や再現性を担保することが可能です。しかし、ウェスタンブロッティングによる定量方法やノーマライゼーションの方法は、統一された手法がなく研究分野によって異なってしまっているのが現状です。
生化学分野を現在もリードし続けている老舗雑誌であるJournal of Biological Chemistryは、論文でのデータ報告における理想と現実の間の3つの大きなギャップとして、「実験デザインの完全開示と実験不確実性・再現性」、「定量データの統計解析と適切なグラフ表示」と並び「ウェスタンブロッティングにおける画像表示と定量」を挙げています 3。
この雑誌で最近発表された定量ウェスタンブロッティングに関するガイドラインの改訂版では、ハウスキーピングタンパク質(HKP)を用いた一般的なノーマライゼーションに換わり、総タンパク質ノーマライゼーション(TPN)がより推進されていくことが反映されています。
避けられつつあるハウスキーピングタンパク質(HKP)
GAPDH、α -チューブリン、β-アクチン、シクロフィリンBのようなハウスキーピングタンパク質(HKP)は、ノーマライゼーションのための内在性コントロールとして何十年も使用されてきました。HKPによるノーマライゼーションでは、標的タンパク質の発現レベルを、選択したHKPに対する比率として相対的に算出できます。このHKPによるノーマライゼーションは、現在でも最も使用されている方法です。
HKPによるノーマライゼーションの問題は、実験全体に渡ってHKPの発現が一定であると仮定している点であり、多くの研究においてこの仮定が常に当てはまるとは限らないことが証明されています。2013年に公開された論文 4では、細胞の種類や個体の発生段階、組織の発達段階や種類、病理学的状態だけでなく、転写後調節や実験条件など、様々な状況によってHKPの発現が変化することを報告しています(論文のTable 1 5)。さらに、通常は標的タンパク質よりもHKPは存在量が豊富であるため、ウェスタンブロッティングで検出したバンド強度が簡単に飽和してしまい、結果を誤った解釈へ導きやすい(論文のFigure 4 6)ことが指摘されています。
私たちサーモフィッシャーサイエンティフィックの実験データからは 、サンプルタンパク質(HeLa細胞ライセート)のローディング量として30 µg 程度から、GAPDHとα-チューブリンの検出シグナルが飽和し始めたことが分かります(図1)。
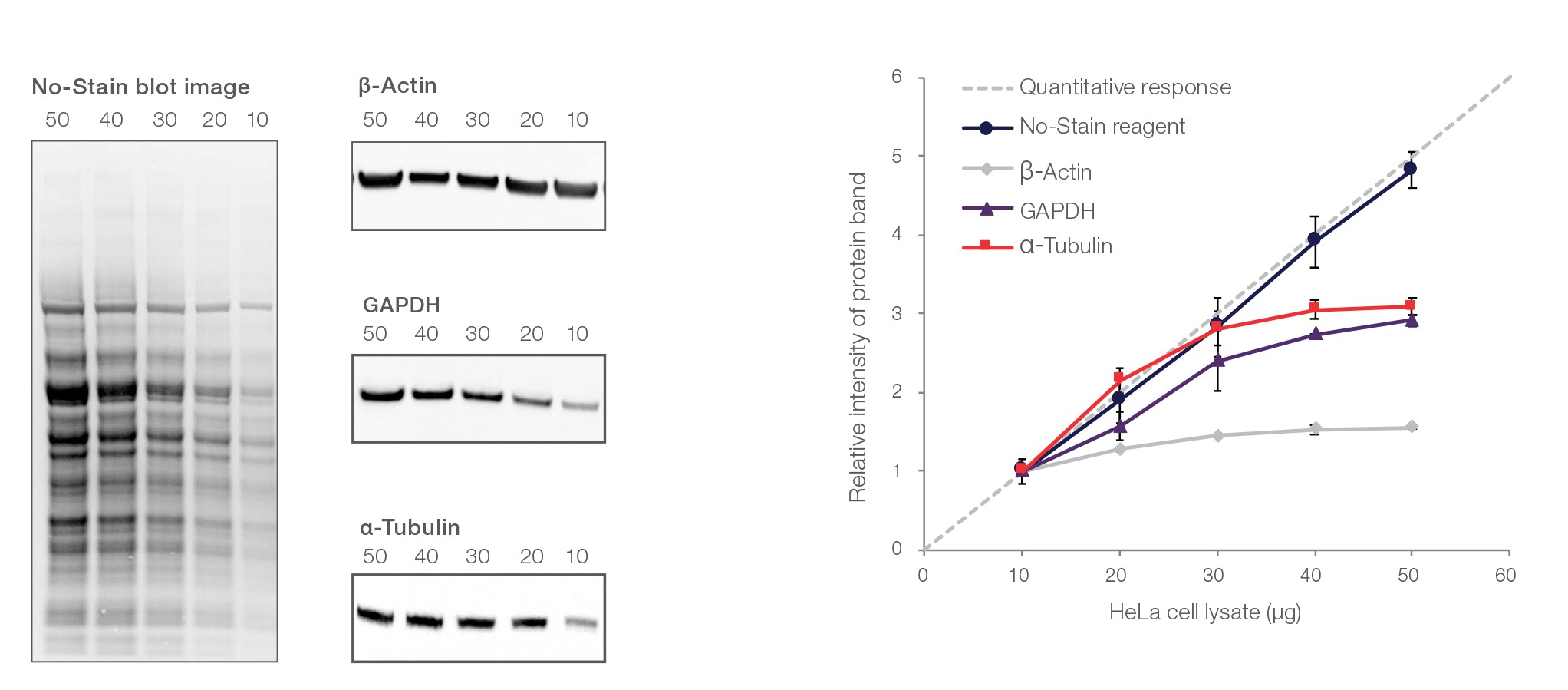
図1. No-Stain Protein Labeling Reagentを用いた総タンパク質のノーマライゼーション
Bolt 4 – 12% Bis-Tris Plusゲルに10 – 50 µgのHeLa細胞のライセートをローディングし、1×MESランニングバッファーを用いて電気泳動を実施しました。Invitrogen™ iBlot™ 2 Gel Transfer Device※とiBlot 2 Transfer Stacks, PVDF, miniを用いてゲルからPVDF膜にタンパク質を転写しました(P0プロトコル、7分間)。PVDFメンブレンを20 mLの超純水で2分間×2回洗浄した後、10 mLのNo-Stain標識溶液で10分間振とうして染色しました。その後、20 mLの超純水で2分間×3回洗浄し、β-アクチン(製品番号Cat.No. AM4302)、GAPDH(製品番号398600)、α-チューブリン(製品番号138000)による抗体反応を行った後、goat anti-mouse Alexa Fluor Plus 680(製品番号A21058)を反応させ、iBright Imagerを用いて画像化しました。iBrightに内蔵されているソフトウエアを用いて、レーン中の総タンパク質シグナルを定量しました。No-Stain Protein Labeling Reagentを用いた各レーンの総タンパク質量のデータから直線回帰したR2の値は0.9990だったのに対し、β-アクチン、GAPDH、α-チューブリンに対するR2の値はそれぞれ0.8851、0.9438、0.8332 でした。
※iBlot 2 Gel Transfer Deviceは、販売終了しております。後継機種はInvitrogen™ iBlot™ 3 Western Blot Transfer Deviceです。
このことは、HKPによるノーマライゼーションの難しさを示しています。つまり、HKPと標的タンパク質の両方のタンパク質の検出シグナル強度が、タンパク質のローディング量に直線的に比例する範囲を特定し、最適化する必要があります。しかし、この直線の範囲は非常に狭くなることもあり、時には存在しないこともあります。また、HKPは標的タンパク質と同じサイズの場合、移動度が同じになり、これらをサイズで区別することが困難になる場合があります。さらに、HKPに対する抗体が、標的タンパク質と交差反応を起こしてしてしまう場合も考えられます。
定量ウェスタンブロッティングの新しいゴールドスタンダード ~総タンパク質ノーマライゼーション(TPN)~
幸運なことに、ハウスキーピングタンパク質(HKP)だけがノーマライゼーションの手法というわけではありません。総タンパク質ノーマライゼーション(TPN)は、単一のローディングコントロールに依存せず、各レーン中の総タンパク質量に対して標的タンパク質の量をノーマライゼーションする方法です。
TPNは実験操作の影響を受けにくく、検出のダイナミックレンジが広いことに加え、電気泳動や転写の結果に関する情報も得られます。これらの理由から、TPNは正確な定量を行うための優れた方法であり、最近では論文のレビュー過程でも頻繁に要求されるようになっています。TPNは、総タンパク質の染色または標識のいずれかで達成可能です。総タンパク質標識法は、迅速かつ簡便で高感度であるため、特に魅力的です。総タンパク質染色と比較して、蛍光標識法はバックグラウンドが低く、脱色工程が不要で、均一で強いシグナルとしてタンパク質を可視化できます。
当社、サーモフィッシャーサイエンティフィックの研究開発者たちにより、Invitrogen™ No-Stain™ Protein Labeling Reagentが開発され、ゲル内またはウェスタンブロッティングのメンブレン上の総タンパク質を効率的かつ迅速に蛍光標識した後、Invitrogen™ iBright Imaging Systemで高解像度のイメージングを行えるようになりました(図2、および動画 )。
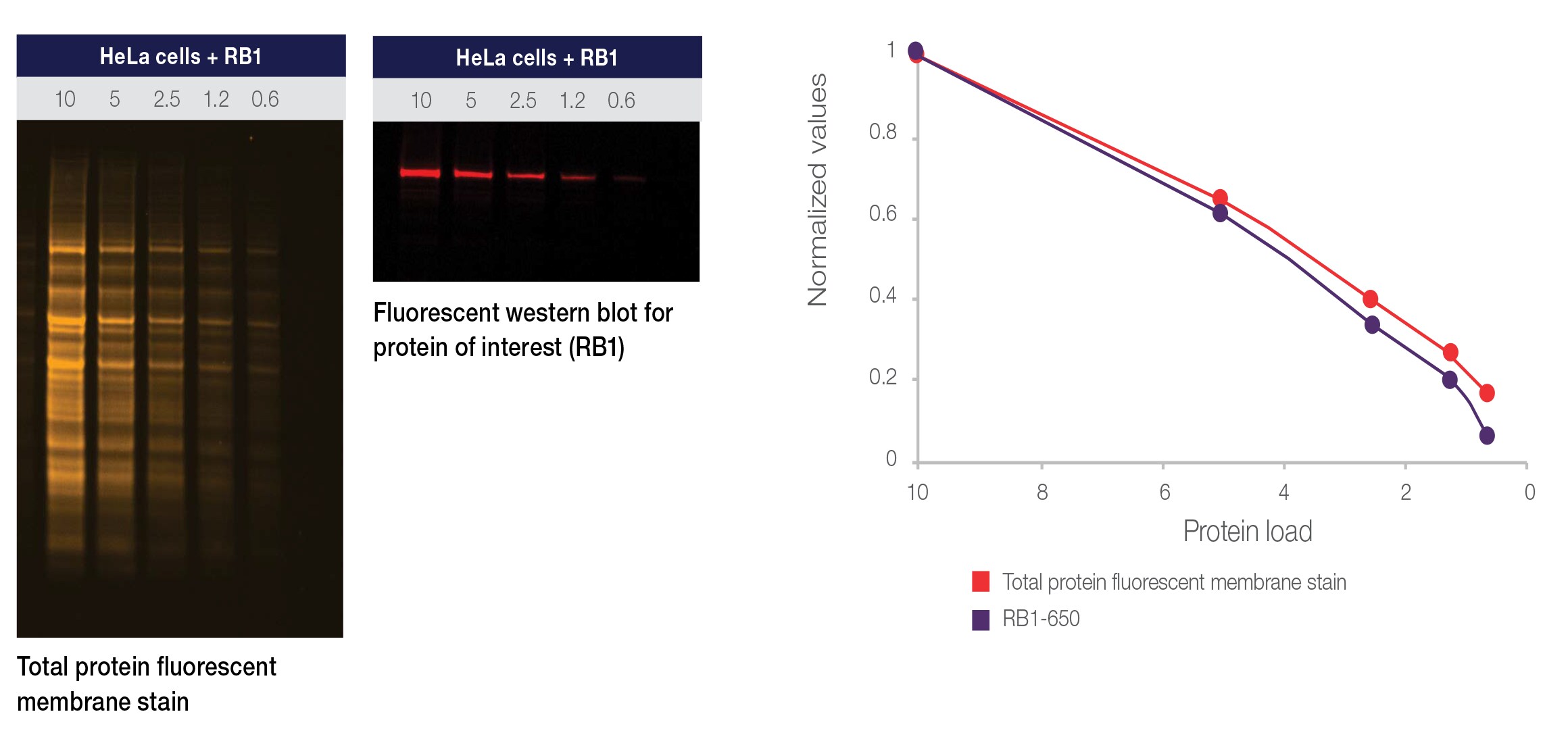
図2. No-Stain Protein Labeling ReagentとiBright Imaging Systemを用いた定量分析
Novex 4 – 12% Tris-Glycine gelに、RB1を発現しているHeLa細胞のライセートを総タンパク質量0.6 – 10 µgの範囲でローディングし、電気泳動を行いました。iBlot 2 Dry Blotting Systemを用いて、ゲルからニトロセルロースメンブレンへタンパク質を転写しました。次に、No-Stain Protein Labeling Reagentを用いてニトロセルロースメンブレンを10分間標識し、iBrightイメージャーで標識メンブレンを画像化しました。同じ標識メンブレンを用いて、Alexa Fluor 645色素で標識した特異抗体でRB1を検出しました。iBright付属のソフトウエアを用いて、それぞれのシグナル強度から、総タンパク質量およびRB1の発現量を定量しました。
出版社によって、入稿時のファイルの形式、サイズ、命名規則などの既定はさまざまですが、生物学のトップジャーナルはデータの透明性と質を重視しています。選択肢を広げ、最初から 厳しい投稿基準に備えたい場合は、TPNを選んだ方が無難です。特に、ウェスタンブロッティングによる定量結果が論文の結論にかかわるような位置づけになるのであれば、初めからTPNを選択していただくことをおすすめします。また、すべての実験パラメーターと未加工のオリジナル画像をトレーサビリティーがとれるように保存することも重要です。英語版のブログでは、免疫学やタンパク質化学の分野で人気のある雑誌におけるウェスタンブロッティングの出版ガイドライン 7がまとめられています。
ウェスタンブロッティングの画像を提示する際に避けるべき間違い
2022年にPLoS Biologyにて発表された研究 8では、神経科学と細胞生物学のジャーナルの上位25%に掲載されたウェスタンブロッティングの画像を含む551の論文が調査されました。これらの論文の90%は、トリミングされたブロット画像だけが掲載され、多くの場合、読者が利用できる補足的なデータソースは掲載されていませんでした。Methodsセクションでは、ゲルにロードされたタンパク質量、ブロッキングステップ、抗体濃度などの標識に関する情報が欠けていること、具体的な一次抗体の情報(メーカー名や製品番号、モノクローナル抗体であればクローンIDなど)が省略されていることが多いという調査結果でした。
ウェスタンブロッティングの不完全なデータ
最も一般的な間違いを避けるための9つのヒント
- お化粧直しは避ける
- プレースホルダーや重複がないか投稿前にチェックする
- オリジナルデータを保存し、補足資料として公開することも検討する
- 誤解を招かないようにする
- 画像のトリミングや接合に注意する
- ブロットデータをPowerPointに保存しない
- 抗体情報やローディング量など、すべての方法を文書化する
- 図の説明文に重要な情報を含める
- ローディングコントロールを適切に使用する
斑点や汚れはウェスタンブロッティングにはつきものです。それ自体は問題ありませんが、これらを部分的に取り除いたり、余計なバンドを隠したりするために画像をデジタル処理することは避けるべきです。不用意なデータ操作を避けるために、画像はそのままにしておきましょう。
プレースホルダー(Microsoft™ PowerPoint™のテキスト入力欄)を残したままにしてしまい、後で見返すのを忘れてしまうことは誰にでもあります。投稿する前には、特に新鮮な目で最終稿チェックをすることで、大きな効果が期待できます。
信頼性と再現性を得るためには透明性が重要であり、ジャーナルはこの目的のために生データファイルを要求することが多いです。必ずオリジナルファイルを保存・整理し、投稿プロセスを通じて手元に置いておきましょう。
多くの場合、誤解を招くような図表は意図的に作成されたものではありません。心配な場合は、「ぱっと見ではどんな印象を与えるだろう?」と考えると良いでしょう。
画像のトリミング(例えば、無関係なレーンの削除)が必要な場合は、画像に明記するとともに、図のレジェンドでも説明してください。出版物によっては、異なるゲルやメンブレンの画像を1つに接合することを禁止しているものもあります。
PowerPointは、重要なブロットデータをアーカイブしたり保存したりする場所としては最悪です。PowerPointは画像ファイルを圧縮してしまうため、出版に適した画質よりも低くなってしまいます。また、Science誌のように、PowerPointファイルを受け付けない雑誌もあります。後世に残すためには、オリジナルのTIFFまたは元の画像ファイル形式のままを保管・保存してください。
ウェスタンブロッティングの再現性に関しては、細部が重要です。特に一次抗体の情報やタンパク質サンプルのローディング量に関する情報は重要です。PLoS Biology誌の論文では、抗体情報を報告するための有用なテンプレート(論文のS3 Table 9)など、データの再現性を向上させるためのツールボックスが紹介されています。
図の説明文は、画像の編集、接合、トリミングを透明化する場所です。必要な情報を加えましょう。
Cell Pressによると、「ウェスタンブロッティングやRT-PCRの図におけるローディングコントロールの重複や誤用について、他のどの問題よりも質問が多く寄せられる」とのことです。言うまでもありませんが、ローディングコントロールは必ず実験サンプルと同じゲルとウェルで行ってください。
まとめ
- ウェスタンブロッティングはタンパク質の検出だけでなく、相対的な違いを測定するための方法でもあります。
- 定量的な解析が可能になり、正確なデータを取得できるようになりました。
- 定量ウェスタンブロッティングのガイドラインが導入され、データの整合性を保つための取り組みが進んでいます。
- 正しいノーマライゼーションや高品質画像の提出が”出版可能な”ウェスタンブロッティングのデータ準備には必要です。
- ハウスキーピングタンパク質(HKP)から総タンパク質ノーマライゼーション(TPN)へのシフトが進んでいます。
- TPNでは総タンパク質の染色や標識を利用し、より正確な定量を可能にします。
- オリジナルデータの保存や補足データの提出、画像のデジタル処理には注意が必要です。
- ガイドラインやベストプラクティスに従うことは、正確性と再現性の向上につながります。
このブログが、定量ウェスタンのデータ取得や論文の出版、ご研究の進展にお役に立てば幸いです。
【無料ダウンロード】タンパク質解析ワークフローハンドブック
効率的なタンパク質の抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
このブログに関連する補足情報
Handbook: Western Blotting Handbook
Overview: Total Protein Normalization No-Stain Protein Labeling Reagent for Western Blotting
Overview: Western Blot and Gel Imaging with iBright Imaging Systems
App Note: Getting publication-ready data from your western blotting experiments
Peer-Reviewed Publication: “Biological validation of a novel process and product for quantitating western blots” (Journal of Biotechnology, 2021).
参考資料
2. 2024 Guide to Quantitative Western Blot Publication
3. Transparency Is the Key to Quality
4. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting
7. Journal-Specific Western Blot Publication Guidelines
研究用にのみ使用できます。診断用には使用いただけません。
