年々、進化し続けるリアルタイムPCR。一昔前は当たり前だったやり方が、必ずしも最適とは言いきれない場合も出てきています。その1つの例が、検量線法です。
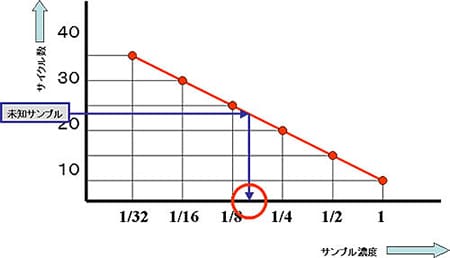
リアルタイムPCRで検量線をひく場合、先ずは標準サンプルを測定し、作成したスタンダードサンプル検量線をもとにサンプルの定量を行います(図1)。
このような検量線法は、増幅効率を反映するため、正確な定量結果を得ることができます。しかし近年は、より効率的な実験ができる「比較Ct法(⊿⊿Ct法)」が、検量線法に代わって研究現場でつかわれるケースが増えてきています。
比較Ct法の一番の特徴は、「検量線をひかなくとも良い」ということです。標準サンプルの測定をおこなわず、内在性コントロールでサンプル間の補正をし、相対定量します。検量線作成のために使用する試薬の量を減らすことができ、実験の操作も少なくてすみます。多サンプルを処理できるメリットもあるので、コツをおさえて、ぜひ活用いただきたいです。
なるほど。では、比較Ct法の原理をみていきましょう。
比較Ct法とは、基準となるサンプル(キャリブレーター)と比較して、未知サンプルが何サイクル早く、あるいは何サイクル遅くThreshold Lineに到達するかを検出し、相対定量する方法です。検量線法で必要とされる標準サンプルの測定はいりません。
そもそもリアルタイムPCRの定量が、“増幅産物がある量に達するのに、PCRを何サイクルおこなったかがわかれば、初期量がわかる”という理論に基づくことを覚えていますか?テンプレートの初期量をサイクル数というものさしで計るのが、リアルタイムPCR。つまり、テンプレート間でPCR反応を1サイクルまわすことで生じる増幅産物の量の差は、初期テンプレート量の違いを反映しています。
ここで大事なのは、PCRの増幅効率が1であれば、増幅曲線が1サイクル早く立ち上がることはテンプレートの初期量が2倍である、逆に1サイクル遅く立ち上がるとことはテンプレートの初期量が半分である、という法則が成り立つことです(図2)。
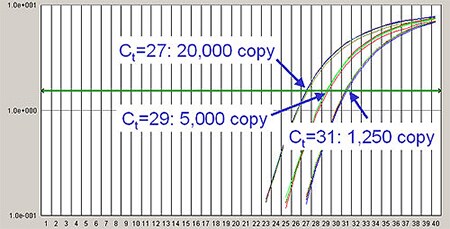
図2:初期テンプレート量が既知の3つのサンプル(1,250、5,000、20,000コピー)に対する増幅曲線。Threshold Cycle(Ct)は各増幅曲線の間隔が2サイクルずつ異なっている。このことから、各々サンプルの初期テンプレート量が2の2乗、つまり4倍ずつ異なることがわかる。
比較Ct法では、この“1サイクルの検出の違いが、2倍量の差である”という理論をつかい、定量結果を2サイクル数の差倍という式(式①)で求めます。
$$2-\Delta \Delta { C }_{ t }\cdots \cdots 式①$$
⊿Ctと⊿⊿Ctの求め方
1. ⊿Ct=ターゲット遺伝子÷内在性コントロール遺伝子(乗数の割り算は引き算)
∴⊿Ct=ターゲット遺伝子Ct-内在性コントロールCt
2. ⊿⊿Ct=各サンプル÷キャリブレータサンプル(乗数の割り算は引き算)
∴⊿⊿Ct=各サンプル⊿Ct-キャリブレータサンプル⊿Ct
※比較Ct法が成立する条件
- ターゲット遺伝子と内在性コントロール遺伝子のPCR効率がほぼ等しい
- 希釈によって⊿Ct値が変動しない=検量線を描いた時の傾きが同じ
- PCR効率が1に近い
- 設計のガイドラインに基づくとPCR効率の下がらない短いAmpliconサイズの設計が可能
※キャリブレータサンプルは、刺激前サンプルや0時間サンプルなど相対量の基準にしたいサンプルを1つ設定
次回は、実際の実験データを取り上げながら、比較Ct法を極めます。お楽しみに!
【無料ダウンロード】リアルタイムPCRハンドブック
このハンドブックでは、リアルタイムPCRの理論や実験デザインの設計など、リアルタイムPCRの基礎知識が掲載されています。リアルタイムPCRを始めたばかりの方やこれから実験を考えている方にうってつけのハンドブックです。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
【無料公開中】リアルタイムPCRトラブルシューティング
異常なS字状の増幅曲線、NTCでの増幅検出、増幅が見られないなど、リアルタイムPCRの実験中に困った際の手助けになる情報を紹介しています。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
研究用にのみ使用できます。診断用には使用いただけません。