マイクロアレイを使用した遺伝子発現解析は現在もっともポピュラーな方法で、発現比較研究やバイオマーカー探索に広く使用されてきた実績があります。近年も、選択的スプライシングやIncRNA解析を中心にアレイは広く使用されており、マイクロアレイは遺伝子発現解析の中心プレーヤーであるといえます。
今回のブログでは、GeneChip™ WT Pico Kitのサンプル調製に関する手引きをご紹介します。GeneChip™ WT Pico Kitはフレキシブルで高感度なターゲット調製法で、わずか10細胞による全トランスクリプトーム(WT)アレイを用いた正確かつ精密な解析を可能にします。この簡易プロトコルを参考に、若い研究者さま方にも改めて、GeneChip WTアレイのサンプル調製に関するあれこれを広く知っていただければと思います。
対象製品:Applied Biosystems™ GeneChip™ WT Pico Reagent Kit
対象製品番号:902622(12反応分)、902623(30反応分)
公式ユーザーガイドと併せてご覧ください。
※WT Pico eagent Kitにはマイクロアレイは付属しません。WT Pico Reagent Kitとマイクロアレイのセット品、もしくはWT Pico Reagent Kitに対応するマイクロアレイをご購入ください。マイクロアレイと試薬の選択についてはExpression Microarray Reagent Guideをご参照ください。
▼もくじ
- このキットのほかに、あらかじめご用意いただく試薬
- アッセイに使用するRNA量
- Section 1:Poly-A RNA Controls、Total RNAの準備
- Section 2:First-Strand cDNA合成
- Section 3:3′ Adaptor cDNA合成
- Section 4:Double-Strand cDNA合成
- Section 5:In Vitro TranscriptionによるcRNA合成
- Section 6:cRNA精製
- Section 7:cRNA収量の確認
- Section 8:2nd-Cycle ss-cDNA合成
- Section 9:RNase Hを用いたRNA Hydrolysis
- Section 10:2nd-Cycle ss-cDNA精製
- Section 11:ss-cDNA収量の確認
- Section 12:ss-cDNAのフラグメント化とラベル化
- Section 13:ハイブリダイゼーション
- Section 14:洗浄と染色、スキャン
- まとめ
このキットのほかに、あらかじめご用意いただく試薬
・100%エタノール
・Applide Biosystems™ GeneChip™ Hybridizatoin, Wash, and Stain kit (製品番号 900720(30反応分))
アッセイに使用するRNA量
IMPORTANT:
Total RNA容量は5 μL以下にする必要があります(poly-A RNA controlsを使用する場合は3 μL以下)。


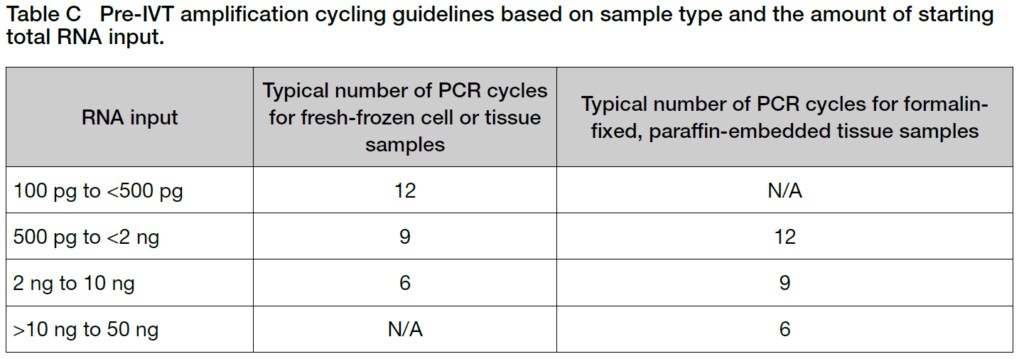
TIP:PCRのサイクル数に関して
Total RNAサンプルの品質が低く、このキットを用いてcRNAの収量が十分に得られなかった場合、Table CのPCRサイクルガイドラインのサイクル数を1~2回増やすとcRNAの収量が改善することがあります。
TIP:試薬調製に関して
・キットの凍結融解は3回以下で使用してください。
・酵素類は穏やかにボルテックスにかけて混合してください。バッファー類は沈殿物がなくなるまで、ボルテックスにかけてよく混合してください。
・マスターミックスやサンプルは穏やかにボルテックスにかけて、よく混合した後に素早くスピンダウンして、溶液を集めてください。
・マスターミックスはピペッティングによるロスに備えるために10%程度過剰に調製してください。
・反応後はサンプルチューブを簡潔にスピンダウンし、次のステップに進む前には氷上に置いてください。
・酵素をマスターミックスに加えるのは反応を行う直前に行うようにしてください。
Section 1:Poly-A RNA Controls、Total RNAの準備
1. 使用するTotal RNA量に応じて、Poly-A RNA Controlsを希釈してください。
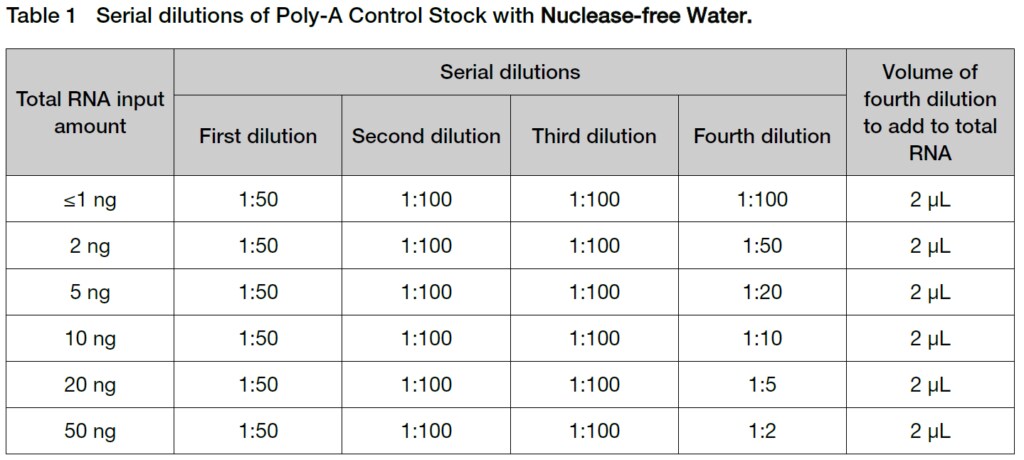
TIP:希釈する時は正確性や一貫性を維持するために2 uL未満の容量でのピペッティング操作は避けてください。
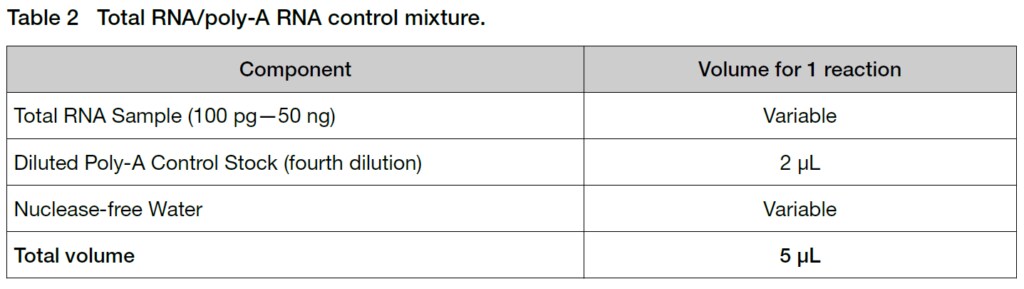
Section 2:First-Strand cDNA合成
1. 氷上でマスターミックスを調製します。
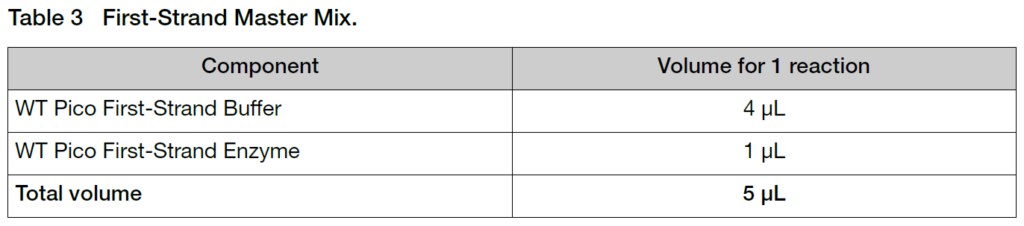
2. 氷上で反応に使用するチューブへマスターミックス5 uLを分注し、Table 2で作成したTotal RNA/Poly-A Control Mixtureを加えます。
3. First-Strand cDNA Synthesis program (Table B参照)に従って、サーマルサイクラーにて25℃で5分、42℃で60分、4℃で2分以上の反応を行います。
4. 反応終了後は速やかにCleanupの行程へ進みます。
5. 氷上で各cDNAサンプル10 uLにWT Pico Clean up Reagent 2 uLを加えます。ピペッティング操作で2回注意深く混ぜた後、泡が立たないように混ぜ、スピンダウンを行います。
6. Cleanup program (Table B参照)に従って、サーマルサイクラーにて37℃で30分、80℃で10分、4℃で2分以上の反応を行います。
Section 3:3′ Adaptor cDNA合成
1. 氷上でマスターミックスを調製します。
NOTE:マスターミックスを調製している間にサーマルサイクラーのブロック温度を15℃にあらかじめ冷却しておきます。また、サーマルサイクラーのふたについては、加熱を止めるか、ふたの温度制御ができないサーマルサイクラーの場合はふたを開けたままで反応してください。
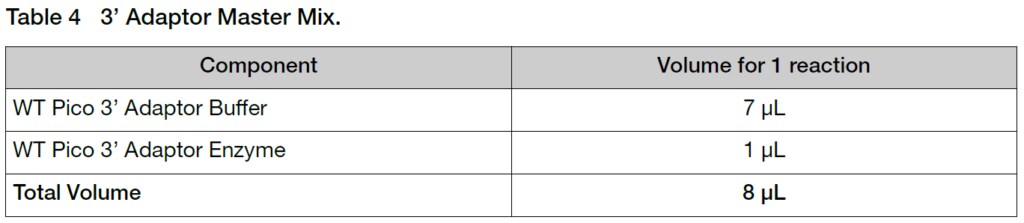
2. 氷上で反応に使用するFirst Strand cDNAサンプル12 μLにマスターミックス8 μLを加えます(Total volume 20 μL)。
3. 3’ Adaptor cDNA Synthesis program (Table B参照)に従って、サーマルサイクラーにて15℃で15分、35℃で15分、70℃で10分、4℃で2分以上の反応を行います。
Section 4:Double-Strand cDNA合成
1. 氷上でマスターミックスを調製します。
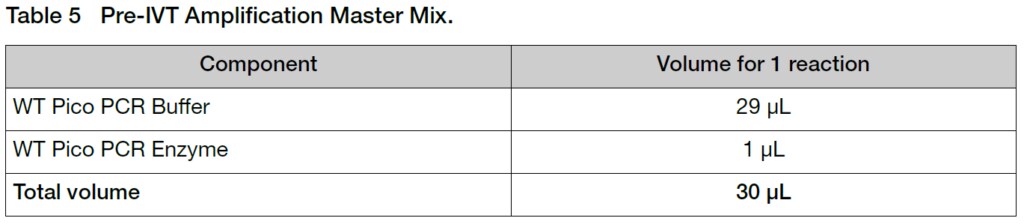
2. 氷上で各3’ Adaptor cDNAサンプル20 μLにマスターミックス30 μLを加えます(Total volume 50 μL)。
3. Pre-IVT Amplification program (Table B参照)に従って、サーマルサイクラーにて95℃で2分、6 or 9 or 12 cycles数にて94℃で30秒と70℃で5分の反応を行い、最後は4℃で2分以上置きます。サンプルタイプとTotal RNAインプット量に基づくPCRサイクルのガイドラインについては、Table Cを参照してください。
4. 反応終了後は速やかにIn Vitro Transcription反応に進みます。
Section 5:In Vitro TranscriptionによるcRNA合成
1. マスターミックス調製時、Double-Strand cDNAサンプルは室温に5分以上置きます。
NOTE:IVT Bufferを10分以上室温に置いてから、マスターミックスを調製してください。
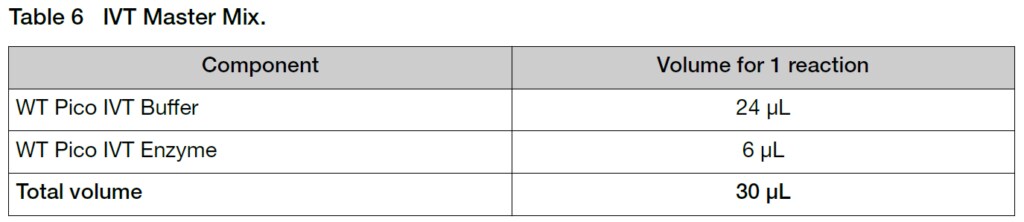
2. 室温でマスターミックスを調製します。
3. 室温で各Double-Strand cDNAサンプル50 μLにマスターミックス30 μLを加えます(Total volume 80 μL)。
4. In Vitro Transcription cRNA program (Table B参照)に従って、サーマルサイクラーにて40℃で14時間の反応を行います。
5. 反応終了後はcRNA精製に進むか、速やかに冷凍保存します。
TIP:In Vitro Transcriptionの14時間の反応は、16時間まで延長が可能です。
TIP:STOPPING POINT~cRNAサンプルは-20℃で一晩保存できます。
Section 6:cRNA精製
cRNA精製を始める前に:
・少なくとも10分間はNuclease-free Waterを65℃にあらかじめ加温しておきます。
・精製ビーズは使用前によく混合しておきます。適当量を分割して室温で保持します。各反応サンプルに対して
140 μL+10%過剰量が必要になります。
・80%エタノール洗浄液は必ず用時調製します。各反応サンプル対して600 μL+10%過剰量が必要になります。
NOTE:すべての行程を室温で行います。
精製ビーズへのcRNA結合
- 精製ビーズを再懸濁するためによく混合します。精製ビーズ140 μLを丸底ウェルプレートの未使用ウェルに移します。続いてビーズの入ったウェルに各cRNAサンプル80 μLを加えて、ピペッティング操作で混合します。
- ピペッティング操作を10回行ってよく混合した後、10分間静置します。
- 磁気ビーズを集めるためにプレートをマグネットスタンド上に移動させて、5分間程度静置します。
- 磁気ビーズを分散させないように注意して上清を回収して廃棄します。プレートはマグネットスタンド上に静置しておきます。
精製ビーズの洗浄
- マグネットスタンド上で各ウェルに80%エタノール洗浄液200 μLを加えて30秒間静置します。
- 磁気ビーズを分散させないように注意してゆっくりと80%エタノール洗浄液を回収して廃棄します。
- ステップAとステップBを繰り返し、計3回の洗浄を行います。最終洗浄液は完全に除去します。
- 液体が見えなくなるまで5分間マグネットスタンド上で風乾させます。状況によってはさらに時間を要するかもしれません。ビーズを乾かしすぎないように注意します。
cRNAの溶離
- プレートをマグネットスタンド上から下ろします。各サンプルに、あらかじめ65℃に加温しておいたNuclease-free Water 27 μLを加えて1分間静置します。
- ピペッティング操作を10回行って、よく混合します。
- 磁気ビーズを集めるためにプレートをマグネットスタンド上に移動させて、5分間程度静置します。
- 溶離されたcRNAが含んだ上清をnuclease-freeのチューブに移します。
- 精製されたcRNAを氷上に置き、定量に進みます。
TIP:STOPPING POINT~精製されたcRNAサンプルは-20℃で一晩保存できます。長期保存する場合は、-80℃で保存します。
Section 7:cRNA収量の確認
Thermo Scientific™ NanoDrop™ Spectrophotometerなどの測定機器で260 nmの吸光度測定を行って、cRNAサンプル濃度を測定します。次の工程に進むためには、20 ug以上(833 ng/μL以上)のcRNAが必要です。
Section 8:2nd-Cycle ss-cDNA合成
1. 氷上でNuclease-free Waterを使ってcRNA 20 ugを24 μL容量に調整します。
2. 氷上でマスターミックスを調製します。

3. 氷上で各cRNAサンプル24 μLにマスターミックス16 μLを加えます(Total volume 40 μL)。
4. 2nd-Cycle ss-cDNA Synthesis program (Table B参照)に従って、サーマルサイクラーにて25℃で10分、42℃で90分、70℃で10分の反応を行います。
5. 速やかにRNA Hydrolysisに進みます。
Section 9:RNase Hを用いたRNA Hydrolysis
1. 氷上で各2nd-Cycle ss-cDNAサンプル40 uLにRNase H 4 μLを加えます。
2. よく混合した後、スピンダウンします。
3. RNA Hydrolysis program (Table B参照)に従って、サーマルサイクラーにて37℃で45分、95℃で5分の反応を行います。
4. Hydrolyzed 2nd-Cycle ss-cDNAサンプルを氷上に置きます。
5. 氷上で各Hydrolyzed 2nd-Cycle ss-cDNAサンプル44 μLにNuclease-free Water 11 μLを加えます(Total volume 55 μL)。
6. よく混合した後、2nd-Cycle ss-cDNA精製に進むか、速やかに冷凍保存します。
TIP:STOPPING POINT~Hydrolyzed 2nd-Cycles ss-cDNAサンプルは-20℃で一晩保存できます。
Section 10:2nd-Cycle ss-cDNA精製
ss-cDNA精製を始める前に:
・Nuclease-free Waterをあらかじめ65℃で少なくとも10分間加温しておきます。
・精製ビーズは使用前によく混合しておきます。適当量を分割して室温で保持します。各反応サンプルに対して100 μL+10%過剰量が必要になります。
・80%エタノール洗浄液は必ず用時調製します。各反応サンプル対して600 μL+10%過剰量が必要になります。
NOTE:すべての行程を室温で行います。
精製ビーズへのss-cDNA結合
- 精製ビーズを再懸濁するためによく混合した後、100 mLを丸底ウェルプレートの未使用ウェルに移します。続いてビーズの入ったウェルに各ss-cDNAサンプル55 μLを加えてピペッティング操作で混合します。
- 各サンプルに100%エタノール150 mLを加え、ピペッティング操作を10回行って、よく混合します。20分間静置します。
- 磁気ビーズを集めるためにプレートをマグネットスタンド上に移動させて、5分間程度静置します。
- 磁気ビーズを分散させないように注意して上清を回収して廃棄します。プレートはマグネットスタンド上に静置しておきます。
精製ビーズの洗浄
- マグネットスタンド上で各ウェルに80%エタノール洗浄液200 μLを加えて30秒間静置します。
- 磁気ビーズを分散させないように注意してゆっくりと80%エタノール洗浄液を回収して廃棄します。
- ステップAとステップBを繰り返し、計3回の洗浄を行います。最終洗浄液は完全に除去します。
- 液体が見えなくなるまで5分間マグネットスタンド上で風乾させます。状況によってはさらに時間を要するかもしれません。ビーズを乾かしすぎないように注意します。
ss-cDNAの溶離
- プレートをマグネットスタンド上から下ろします。各サンプルに、あらかじめ65℃に加温しておいたNuclease-free Water 30 μLを加えて1分間静置します。
- ピペッティング操作を10回行って、よく混合します。
- 磁気ビーズを集めるためにプレートをマグネットスタンド上に移動させて、5分間程度静置します。
- 溶離されたss-cDNAが含んだ上清をnuclease-freeのチューブに移します。
- 精製されたss-cDNAを氷上に置き、定量に進みます。
TIP:STOPPING POINT~精製されたss-cDNAサンプルは-20℃で一晩保存できます。
Section 11:ss-cDNA収量の確認
Thermo Scientific™ NanoDrop™ Spectrophotometerなどの測定機器で260 nmの吸光度測定を行って、ss-cDNAサンプル濃度を測定します。次の工程に進むためには、5.5 ug以上のss-cDNAが必要です。
※ビーズ精製後の濃度測定による液量ロスなどを考慮すると、5.5 μg以上を確保するために、吸光度測定時のss-cDNA濃度は目安として212 ng/μL以上必要です。ぎりぎりの場合は必要量に足りるか計算してください。
Section 12:ss-cDNAのフラグメント化とラベル化
1. 氷上でNuclease-free Waterを使ってss-cDNA 5.5 ugを 46 μL容量に調整します。
2. 氷上でマスターミックスを調製します。
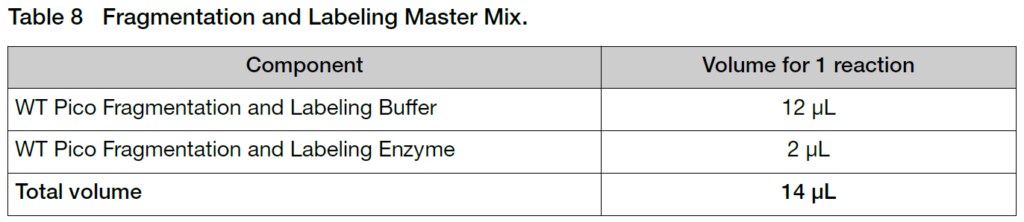
3. ss-cDNAサンプル5.5 μLにマスターミックス14 μLを加えます(Total volume 60 μL)。
4. Fragmentation and Labeling program(Table B参照)に従って、サーマルサイクラーにて37℃で60分、93℃で2分の反応を行い、反応終了後はサンプルを氷上に置きます。
5. 氷上にサンプルを置いてHybridizationに進むか、速やかに冷凍保存します。
TIP:STOPPING POINT~Fragmented and labeled ss-cDNAサンプルは-20℃で一晩保存できます。長期保存する場合は、精製されたss-cDNAで保存することを推奨します。
Section 13:ハイブリダイゼーション
NOTE:
・試薬が使用前には完全に融解していることを確認してください。DMSOは2~8℃で保存すると固まるので、使用後は室温で保存した方が使いやすいです。
・ここの工程では別途購入していただいたGeneChip Hybridization, Wash and Stain Kitを使用します。
1. 20×Hybridization ControlsをHybridization Control program (Table B参照)に従って、サーマルサイクラーにて65℃で5分加熱します。
TIP:キットご購入後、最初に65℃で5分加熱した後は1.5 mLチューブに150 μLずつ小分けにして保存しておくことをお勧めします。凍結融解を3回以内に抑えるためです。
2. 室温でHybridization Master Mixを調製します。使用するアレイによって量が異なるため、Table 9に従って調製してください。
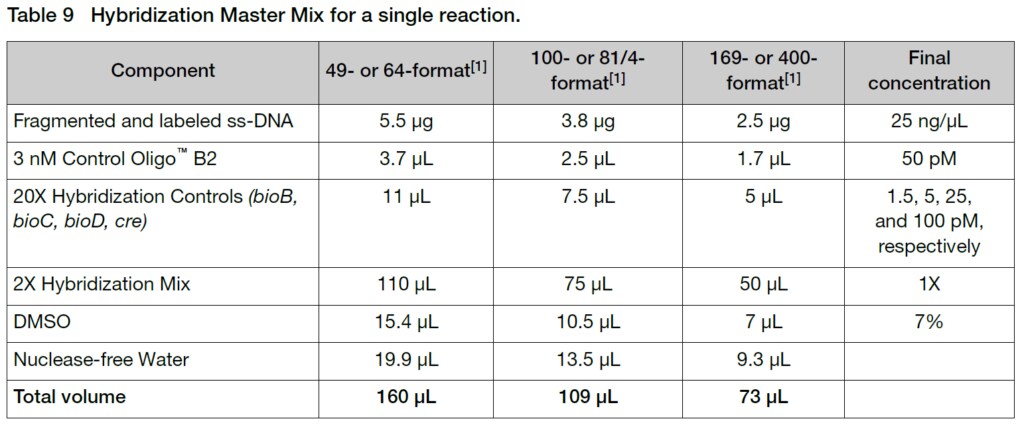
3. 室温で、使用するArrayのフォーマットに対応した量のビオチン標識されたss-cDNAサンプルが入ったチューブにHybridization Master Mixを添加して、Hybridization Cocktailを調製します。
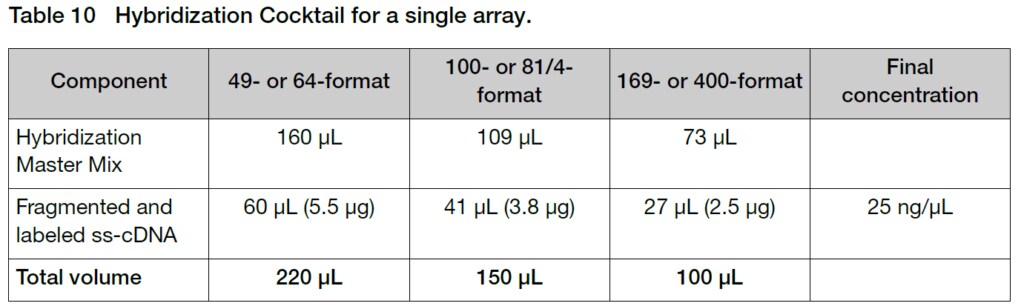
TIP:STOPPING POINT~Hybridization Cocktailは-20℃で1カ月程度、-80℃で1年程度保存できます。
4. 穏やかにボルテックスにかけて、よく混合します。
5. Hybridization CocktailをHybridization Cocktail program (Table B参照)に従って、サーマルサイクラーにて、99℃(チューブの場合)または95℃(プレートの場合)で5分、45℃で5分加熱します。
6. 加熱後、短時間の遠心を行います。
7.各フォーマットに対応した量をArrayに注入します。注入後は注入口のSeptaにタフスポットを貼ります。
 TIP:169 or 400-Formatの場合、英文プロトコルでは注入量が80 μLとなっておりますが、90 μLの注入をお勧めします。これは、ハイブリダイゼーション中の蒸発による析出を防ぎやすくするためです。
TIP:169 or 400-Formatの場合、英文プロトコルでは注入量が80 μLとなっておりますが、90 μLの注入をお勧めします。これは、ハイブリダイゼーション中の蒸発による析出を防ぎやすくするためです。
8. Hybridization Ovenで45℃、60 rpmで16時間のHybridizationを行います。
Section 14:洗浄と染色、スキャン
・サンプル情報登録方法やApplide Biosystems™ GeneChip Fluidics Station、Scannerの操作方法については、GeneChip™ Command Console (GCCまたはAGCC) クイックスタートガイドで確認してください。
・ここでは洗浄と染色作業で使用する試薬類の分注作業などを記載します。
1. Fluidics Stationの電源を入れ、Wash A、Wash B、超純水の入ったボトルをセットして、GCC Fluidics Control※を起動し、Primeを開始します。
※AGCC Fluidics Controlとも呼びます。
2. Hybridizationを行っているArrayの枚数に合わせて、Stain Cocktail 1、Stain Cocktail 2、Array Holding Bufferをそれぞれ分注したvialを準備します。
・Stain Cocktail 1 600 μL (遮光チューブ)
・Stain Cocktail 2 600 μL (透明チューブ)
・Array Holding Buffer 800 μL (透明チューブ)
TIP:Stain Cocktail 1用に遮光チューブのご用意が難しい場合は、透明チューブに入れ、使用直前まで遮光の環境下に置いておいてください。
3. Hybridizationが終了したArrayをHybridization Ovenから取り出してタフスポットをはがし、Hybridization Cocktailを回収します(データが確実に取れたことを確認できるまでは-20℃で保存)。
4. Hybridization Cocktailを回収した後は、各フォーマットに対応した量のWash AをArray内に注入します。
 5. GCC Fluidics ControlでWash and Stainを開始します。
5. GCC Fluidics ControlでWash and Stainを開始します。
ArrayのFormatによって使用するプロトコルが異なります。
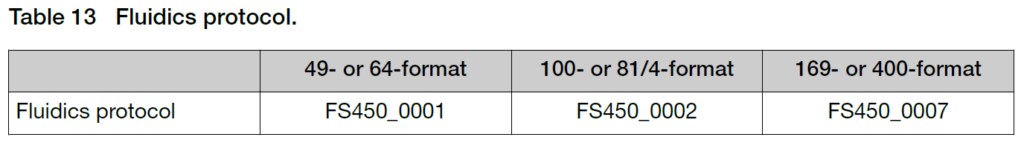
また、このタイミングでScannerの電源を入れておきます。
6. Fluidics Stationの液晶画面にEJECT & INSPECT CARTRIDGEが表示されたらArrayを取り出し、ガラス面に気泡がないことを確認し、Septaにタフスポットを貼ります。もし、気泡が認められたら、マイクロピペットを使ってArray Holding Bufferを気泡が入らないように入れ直してからタフスポットを貼ります。
7.GCC Scan Control※を起動し、ArrayのScanを開始します。
※AGCC Scan Controlとも呼びます。
8. Fluidics Stationを続けて使用する予定がなければ、Wash A、Wash Bのボトルを超純水の入ったボトルに交換し、GCC Fluidics ControlでShut Downを行います。Shut Down終了後、GCC Fluidics Controlを閉じ、Fluidics Stationの電源を切ります。
9. ArrayのScanが終了したらGCC Scan Controlを閉じ、Scannerの電源を切ります。
まとめ
プロトコルに関するご不明点や気になる点はテクニカルサポートまでお問い合わせください。
研究用にのみ使用できます。診断用には使用いただけません。



