次世代シーケンサは遺伝子を網羅的かつ多様な用途(変異解析や発現解析など)で解析できる非常に強力な分析装置です。一昔前までNGS(Next Generation Sequencing)は敷居が高く、誰でも簡単に手が出せる装置ではありませんでした。しかし、近年は実験方法が定着してきたことや新たな次世代シーケンサの開発などにより、以前より扱いやすい分析機器になってきたといえます。
一方、実験コストについては以前よりかなり安価になってきたとはいえ、他の実験系と比較すると依然として高額で、実験に失敗してしまうと大きな損失となります。できるだけ多くのデータを簡単に得ようとした場合、まずどのようなことが思いつくでしょうか。今回はあえてユーザーガイドから外れた条件で実験することで、どの様な結果を招くのか検証を行いました。解析結果を参考に、実際に実験していただく際の注意点をご紹介していきたいと思います。なお、本記事のように推奨を逸脱した条件で実験を行うと結果が得られない可能性がありますので真似されないようご注意ください。
▼こんな方におすすめです!
・NGS解析に興味がある
・NGSの実験方法について知りたい
・テンプレート調製でのライブラリー投入量に悩んでいる
▼もくじ
NGS解析のワークフローと今回の検証内容
Ion Torrent™システムをはじめとする次世代シーケンサでの実験は、一般的には①核酸精製、②目的のDNAあるいはRNAを解析可能な状態に加工するライブラリー調製、③シーケンス解析の前処理にあたるテンプレート調製、④シーケンス解析、という4つのステップに分かれています(図1)。
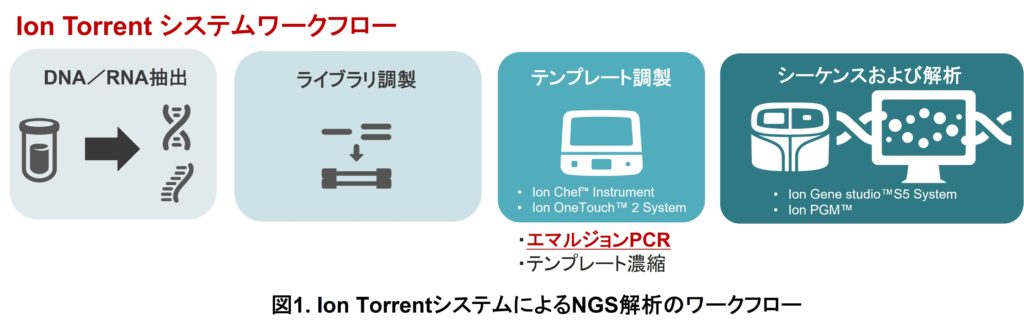
テンプレート調製については各社の次世代シーケンサごとに手法が異なり、Ion TorrentではエマルジョンPCRという方法を採用しています。エマルジョンPCRはオイル中に存在する各水滴内に1分子のライブラリーと1個のアダプターと相補的なDNAが結合したビーズ(ISP:Ion Sphere Particle)が含まれる状態でPCR反応を行うことにより、ISP上にライブラリーを増幅します(図2)。この工程はIon Torrent製品ではIon OneTouch™ 2 SystemやIon Chef™ Instrumentで行われます。エマルジョンPCRはオイル中に存在する各水滴内に1分子のライブラリーと1個のISP(Ion Sphere Particle)が含まれる状態でPCR反応を行うことにより、ISP上にライブラリーを増幅します(図2)。このエマルジョンPCRによってライブラリーを増幅させたISPを最終的に半導体チップにローディングし、各ISPの増幅したDNA配列を解析することでサンプルの配列情報を取得します。

エマルジョンPCRによるテンプレート調製を行う際、PCRの原理を考えるとテンプレート量が多い方がISPの収量が増えるように思えます。しかし、エマルジョンPCRではアプリケーションごとに目安となるライブラリー投入量が決められています。もし推奨を超える濃度で実験を行った場合、どのような結果が生じるのでしょうか。そこで、今回はテンプレート調製でのライブラリー投入量をあえて過剰にすることで解析結果にどのような影響を及ぼすのか検証を行いました。
<合わせて読みたい:ゲノム解析新時代! 今だからこそ聞きたい!Ion Torrent次世代シーケンサの原理>
材料と方法 -Ion GeneStudio S5によるシーケンス解析-
使用した機器
・ Ion S5™ XL System (A27214)
・ Ion Chef™ Instrument (4484177)
使用した試薬
・ Ion 540™ Kit-Chef (A30011)
・ Ion 540™ Chip Kit (A27765)
・ Ion S5™ Controls Kit Plus (A30729) (Human CEPH Control 200 Libraryを使用)
手順
Ion Chef™ Instrumentでテンプレート調製、Ion S5™ XL Systemでシーケンス解析を行いました。半導体チップは1回の解析で6,000~8,000万リード取得できるIon 540™ Chip、解析サンプルはIon S5 Controls Kit Plusの構成品であるHuman CEPH Control 200 Libraryを用いました。このライブラリーは次世代シーケンサのパフォーマンスを確認する際のコントロールとして用いられます。
テンプレート調製時のライブラリー投入量は以下の条件で実施しました。
・ 50 pM(推奨濃度)
・ 200 pM(過剰濃度)
・ 400 pM(過剰濃度)
その他の条件についてはIon GeneStudio™ S5、Ion Chef™およびIon 540™ Kit – Chefのユーザーガイドに従いました。
結果と考察 -なぜライブラリー投入量を増やしてもリード数が増えないのか-
早速シーケンス解析の結果を見ていきましょう。まず、半導体チップのヒートマップ(図3)に着目すると、いずれのライブラリー投入量でも全体が赤く表示されているのがわかります。これはISPが半導体チップ全体にくまなく充填されていることを示しており、ヒートマップの結果を見る限りはいずれの条件でも問題なくローディングできているように見えます。

次にそれぞれの解析結果についてランレポートの詳細を見ていきましょう(図4)。推奨濃度である50 pMでは解析可能なリード数を示すTotal Readsが約7,700万リードとなっておりスペックを十分に満たしています。一方で200 pMでテンプレート調製を行った結果に注目すると、取得リード数は6,400万リードですのでIon 540™ Chipのスペックは満たしていますが、50 pMの解析結果と比べて1,000 万リード以上もTotal Readsが減少してしまいました。各条件での結果を比較すると、200 pMではISP SummaryのClonal割合が68%から57%に減少しているのがわかります。反対にPolyclonalの割合は32%から43%に増加しています。400 pMではTotal Readsが約4,800万リードしか取得できておらず、Ion 540™ Chipで期待されるスペックを満たしていませんでした。ClonalとPolyclonalの割合についても、それぞれ49%と51%となっており、200 pMよりもよりClonalの割合が減少し、Polyclonalが増加しているのがわかります。

ここで出てくるClonalというのは1種類のライブラリー由来のDNA配列が増幅したISPの割合を示します。反対にPolyclonalは複数ライブラリーのDNA配列が増幅しているISPの割合を表しています。すなわち今回の解析結果ではテンプレート調製時のライブラリー投入量を増やすことで複数のDNA配列が増幅したISP(Polyclonal)が増加し、それが原因となって取得リード数が減少したことを示唆しています。
なぜこの様な現象が起こるのでしょうか。
実はエマルジョンPCRの原理と密接な関係があります。冒頭で紹介したようにエマルジョンPCRはオイル中の水滴内に1分子のライブラリーと1個のISPを含む状態でPCR反応を行い、ISP上にDNAを増幅する手法です。しかし、この時に2本以上のDNA断片が1つの水滴内に入ってしまうと複数種類の塩基配列が同一のISP上に増幅(Polyclonal増幅)します(図5)。

つまり、今回の検証実験においてライブラリー投入量を過剰にした条件では水滴内に2本以上のライブラリーが混在する確率が高まり、Polyclonalの割合が増加してしまったと考えられます。PolyclonalとなったISPからは複数のDNA配列のシグナルが検出されてしまうため正常な解析データを取得することができません。このようなリードは解析時にフィルターによって除外されるため、取得リード数を増やそうとしてライブラリー投入量を過剰にしても、残念ながら総リード数は増えるどころか減少してしまうのです。
いかがでしたでしょうか。
テンプレート調製でのライブラリー投入量は単に多くすれば良いという訳ではなく最適な濃度が存在します。よって最も効率よく解析結果を得るためにはユーザーガイドに基づいた適切な条件で実験を行うことが非常に重要になってきます。
実際の実験ではあえて推奨濃度を逸脱してテンプレート調製を行うことは少ないかと思いますが、作製したライブラリーの定量をテンプレート調製前に正確に行えていなかった場合、今回のような過剰量のライブラリーを投入した実験条件が再現されてしまうことがあります。そこで当社ではIonTaqMan™ Library quantification kitを使用したライブラリー定量を推奨しています。この製品を使用すれば、正確な定量値をもとにテンプレート調製でのライブラリーの投入量を決定することができます(Ion Xpress™ Barcode Adapters 1-16 Kit (4471250)およびIonCode™ Barcode Adapters 1-384 Kit (A29751)のアダプターを使用したライブラリーで使用可能、Ion Xpress™ RNA-Seq Barcode (4475485) は非対応ですのでご注意ください) 。
また今回はテンプレート調製についてのご紹介だけでしたが、実はIon Torrent™の解析には実験を安定的に成功させるためのコツが他にもあります。そこで当社では実験の手技を詳細にお伝えする機会として、ハンズオントレーニングを開催しています。トレーニングの中では今回のような実験のポイントを各工程でご紹介していきますので、これから新しくIon Torrentを用いた実験を始められる方、あるいは普段Ion Torrent™を継続して使用しているけれども改めて手技を確認したい方など、ご興味ある方はお気軽に
テクニカルサポートまでご相談ください!
次世代シーケンス データ解析オンライン個別相談
IonTorrentユーザでデータ解析に関する具体的な課題をお持ちの方には、無料の個別相談の時間を開設しています。
研究用にのみ使用できます。診断目的およびその手続き上での使用はできません。



