「こんな製品あったのか!」シリーズでは、あまり知られていないけどぜひ使っていただきたいとっておきの製品をご紹介します。今回ご紹介するのはInvitrogen™ MagicMedia™ E. coli Expression Medium(以下
MagicMedia Medium)という大腸菌発現用培地です。大腸菌の増殖にともない自動的に発現誘導がかかるため面倒なOD測定を省略でき、かつ最適な培地組成により高い発現量が期待できます。本ブログでは、MagicMedia Mediumを使用した以下の検討結果についてご報告いたします。
- 検討1:LB培地(+IPTG)と比較してみた(5 mL、37 ℃)
- 検討2:低温での発現を試してみた(5 mL、20 ℃)
- 検討3:スケールアップしてみた(200 mL、20 ℃)
▼もくじ
MagicMedia E. coli Expression Mediumとは?
検討結果をご報告する前にMagicMedia Mediumについて簡単にご説明いたします。
- BL21(DE3)などの大腸菌とT7プロモーターを持つ大腸菌発現ベクターを組み合わせて、IPTGを添加せずにタンパク質発現を行える。ただし、DH5α、TOP10などの大腸菌株には使用できない
- OD測定が不要で小スケール発現なら前培養も不要(図2)
- LB培地と比較して高密度培養が可能なので高発現が期待できる
- そのまま使える液体タイプと粉末タイプがある(図1)
- 調製が簡単(液体タイプは2液を混合、粉末タイプは水に溶解・オートクレーブ後添加剤を加えるだけ)
図1. MagicMedia E. coli Expression Mediumの写真。A:粉末タイプ、B:液体タイプ
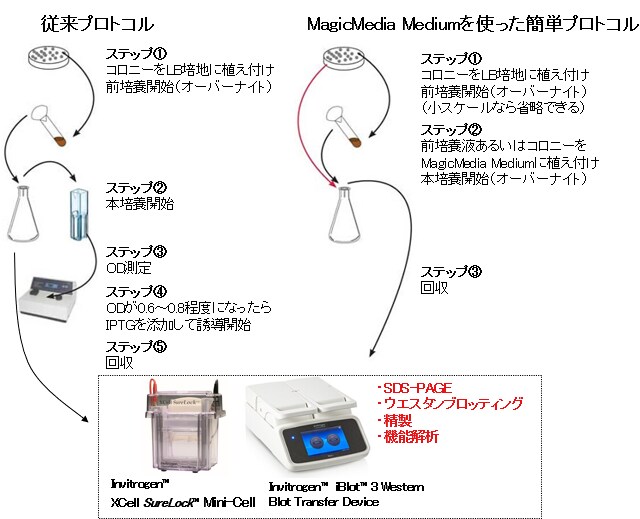
図2. プロトコルの比較。
材料:使用した発現ベクター
- pEXP14-GFP(Invitrogen™ Gateway™ pDEST™14 VectorにGFP遺伝子を組み込んだもの)
- pET300/NT-GW/Rac Kinase(Invitrogen™ Champion™ pET300/NT-DESTにRac kinase遺伝子を組み込んだもの、製品番号K630001に添付されている)
その他材料については本ブログの最後にまとめて記載しています。
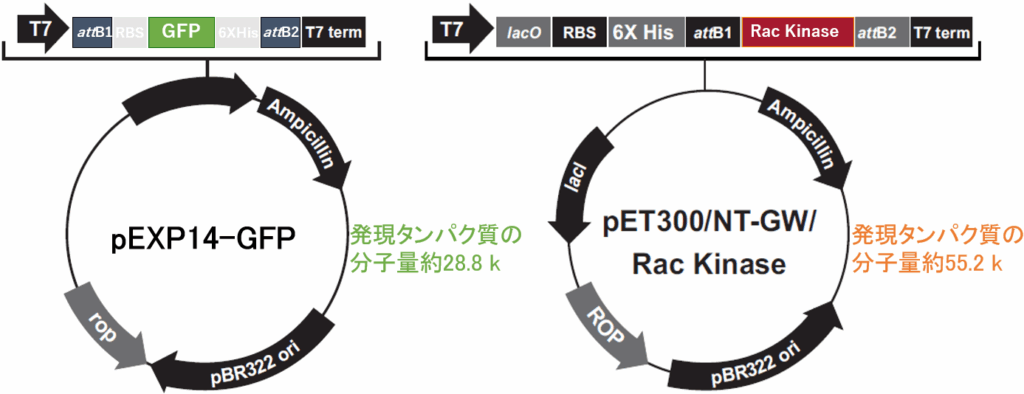
図3. 使用した発現ベクターのマップ(マップの読み方については既存ブログをご参照ください)。
検討1:LB培地(+IPTG)と比較してみた(5 mL、37 ℃)
方法
- LB培地:LB培地5 mL(50 mL容チューブ)に前培養液50 µLを添加→37 ℃で振とう培養開始→時々OD(600 nm)を測定→OD(600 nm)が0.8程度になったタイミングでIPTG添加(終濃度1 mM)
- MagicMedia Medium: MagicMedia Medium 5 mL(50 mL容チューブ)に植菌(コロニーから)→37 ℃で振とう培養開始
- 共に経時的にサンプリング→OD(600 nm)測定およびSDS-PAGE(CBB染色)で解析
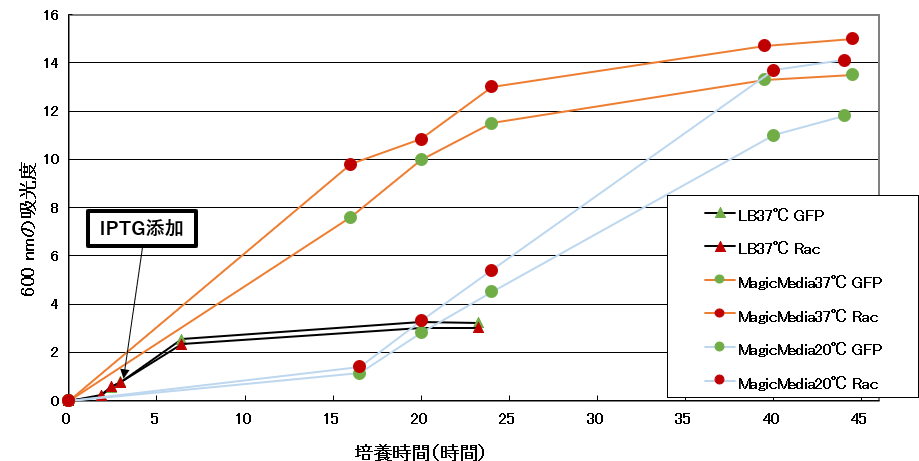
図4. 600 nmの吸光度を元に作成した増殖曲線。培養時間:共に培養開始からの経過時間。LB培地にIPTGを添加したタイミングを矢印で示した。検討2(MagicMedia Medium、20 ℃)の結果も含む。
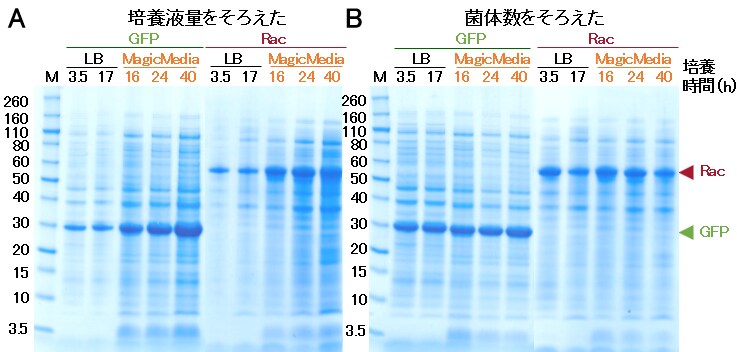
図5. SDS-PAGEの結果。A: 培養液各5 µLをSDS化したものをアプライした。B:OD測定結果を指標に菌体数をそろえたサンプルをアプライした。培養時間:LB培地の結果はIPTG添加後の経過時間。MagicMedia Mediumの結果は培養開始後の経過時間。M: Invitrogen™ Novex™ Sharp Unstained Protein Standard。
結果と考察
吸光度測定の結果から、MagicMedia Mediumの方がLB培地よりも4~5倍高密度培養が可能なことが示唆されました(図4)。また、SDS-PAGEの結果から、培養液量あたりの発現量はMagicMedia Mediumの方が高く(図5A)、菌体あたりの発現量は同程度であることが示唆されました(図5B)。
検討2:低温での発現を試してみた(5 mL、20 ℃)
方法
- MagicMedia Medium 5 mL(50 mL容チューブ)に植菌(コロニーから)→20 ℃で振とう培養開始
- 経時的にサンプリング→OD(600 nm)測定およびSDS-PAGE(CBB染色)で解析
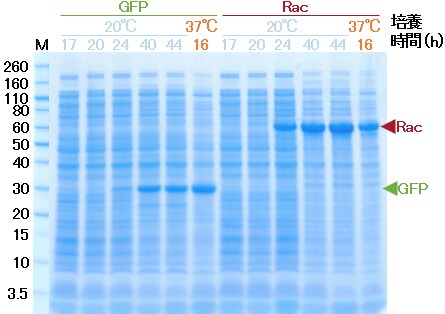
図6 SDS-PAGEの結果。OD測定結果を指標に菌体数をそろえたサンプルをアプライした。培養時間:培養開始後の経過時間。M: Novex Sharp Unstained Protein Standard。
結果と考察
37 ℃と比較して立ち上がりに時間がかかりましたが、最終的には(本実験では40時間後付近37 ℃と同程度の細胞密度まで増殖し(図4)、かつ菌体あたりの発現量も同程度でした(図6)。以上から低温でも問題なく発現できることがわかりました。なお、総タンパク質のSDS-PAGEにおいてCBB染色レベルで発現を確認できたのは培養開始後24時間以降でした。増殖曲線と見比べると、対数増殖期に入ったあたりに発現が誘導されたことが予測されます。
検討3:スケールアップしてみた(200 mL、20 ℃)
方法
pEXP14-GFPを使って検討を行いました。
- 前培養を行う場合:MagicMedia Medium 200 mL(500 mL容フラスコ)に前培養液10 mLを添加→20 ℃で振とう培養開始
- 前培養を行わない場合: MagicMedia Medium 200 mL(500 mL容フラスコ)に植菌(コロニーから)→20 ℃で振とう培養開始
- 共に経時的にサンプリング→OD(600 nm)測定およびSDS-PAGE(CBB染色)で解析
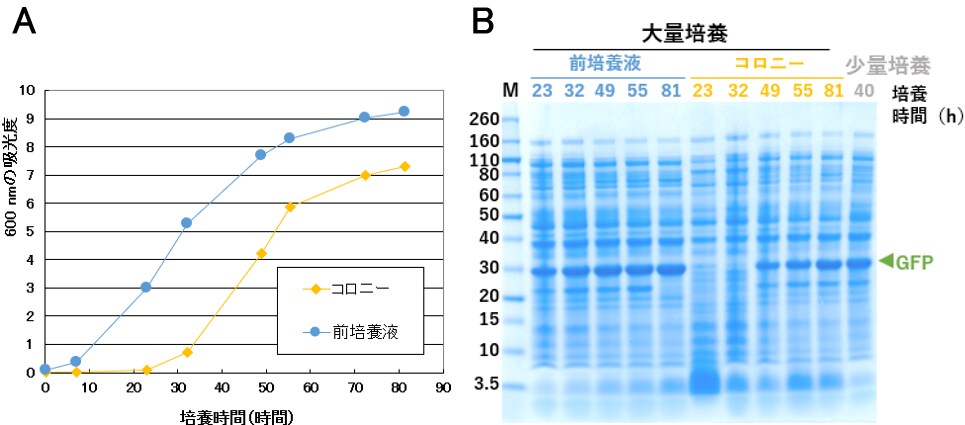
図7. A:600 nmの吸光度を元に作成した増殖曲線。B:SDS-PAGEの結果。OD測定結果を用いて菌体数をそろえたサンプルをアプライした。M: Novex Sharp Unstained Protein Standard。
結果と考察
今回の培養条件では最終的な菌体密度は少スケール培養よりも低くなりましたが、菌体数あたりの発現タンパク質量は同程度でした(図7B)。200 mLにスケールアップしても発現を行えることはわかりましたが、最適な発現条件を見つけるために、液量、培養容器、振とう速度を検討する必要がありそうです。なお、コロニーから培養を開始した場合、対数増殖期に入るまでに一日程度かかり、かつプラトーになる菌体濃度が低くなりそうです。コロニーからでも発現は行えますが、スケールアップを行った場合は前培養を行った方がよさそうです。
まとめ
2遺伝子に関してですが、以下のことを確認できました。
- MagicMedia Mediumを用いてLB培地+IPTGと同等にタンパク質発現を行える
- 細胞あたりの発現レベルはLB培地+IPTGと同程度
- 高密度培養が可能なため、培地量あたりの発現量はLB培地+IPTGよりも高い
- MagicMedia Mediumを用いる場合はIPTG添加が不要なため吸光度測定が不要で大変楽
- 少なくとも小スケール培養であれば前培養も不要
- 低温でも遜色なく発現を行えた
- 200 mLにスケールアップしても発現を行えた
MagicMedia Mediumは、LB培地+IPTGよりもかなり操作が楽なことがわかりました。特にサンプル数が多い場合に力を発揮しそうです。昔96ウェルディープウェルプレートで複数遺伝子の発現解析を行っていましたが、その時にMagicMedia Mediumがあればよかったと思いました。同じような悩みをお持ちの方はぜひ試してみてください。
また実際お試しいただく際に、このベクターは使えるのか?この大腸菌でも大丈夫なのか?など、ご不明な点などありましたらぜひテクニカルサポート(jptech@thermofisher.com)にお問い合わせください。
使用した製品まとめ
| 製品名 | カタログ番号 | サイズ | 備考 | |
| 使用 | Invitrogen™ MagicMedia™ E. coli Expression Medium, Powder | K6810 | 1 L | 粉末 |
| Invitrogen™ MagicMedia™ E. coli Expression Medium, Powder | K6815 | 5 X 1 L | 粉末 | |
| Invitrogen™ MagicMedia™ E. coli Expression Medium | K6803 | 1 L | 液体 | |
| 使用 | Invitrogen™ Luria Broth Base (Miller’s LB Broth Base), powder | 12795027 | 500 g | |
| 使用 | Carbenicillin Disodium Salt | 10177012 | 5 g | |
| 使用 | Invitrogen™ IPTG | 15529019 | 1 g | |
| 使用 | Invitrogen™ One Shot™ BL21 Star™ (DE3) Chemically Competent E. coli | C601003 | 21反応 | |
| 使用 | Invitrogen™ Champion™ pET300/NT-DEST and pET301/CT-DEST Gateway™ Vector Kit | K630001 | コントロールベクターのみ使用 | |
| 使用 | Invitrogen™ Gateway™ pDEST™14 Vector | 11801016 | ||
| 使用 | XCell SureLock Mini-Cell | EI0001 | ||
| 使用 | Invitrogen™ NuPAGE™ Bis-Tris Mini Protein Gels, 4–12%, 1.0–1.5 mm | NP0322BOX | 10 gels | |
| 使用 | Invitrogen™ NuPAGE™ MES SDS Running Buffer (20X) | NP0002 | 500 mL | |
| 使用 | Invitrogen™ Novex™ Sharp Unstained Protein Standard | LC5801 | 2 × 250 µl | |
| 使用 | Invitrogen™ SimplyBlue™ SafeStain | LC6060 | 1 L |
テクニカルセミナー(無料)
ベクターマップの読み方~クローニング・タンパク質発現で迷子にならないために
ハンズオントレーニング(有償)
初めてのクローニング ハンズオントレーニング
ベクターマップの読み方ガイド 無料ダウンロード
Protein Expressionハンドブック 無料ダウンロード
タンパク発現の実験を検討している方や、詳細情報を確認したい方にうってつけのハンドブックです。
関連するブログ記事
研究用にのみ使用できます。診断用には使用いただけません。



