リアルタイムPCRには、多くの蛍光ケミストリが存在します。今回は、TaqMan AssayやSYBR Green色素ベースのアッセイなど、リアルタイムPCRにおける蛍光検出システムについてご紹介します。
▼もくじ [非表示]
リアルタイム蛍光PCRケミストリ
リアルタイムPCRには、多くの蛍光ケミストリが存在しますが、最も広く使用されているのは5′ヌクレアーゼアッセイであり、その中でも最もポピュラーなアッセイはTaqMan Assayです。他の蛍光ケミストリでは、Applied Biosystems™ SYBR™ Green色素ベースのアッセイなどがあります(図1)。
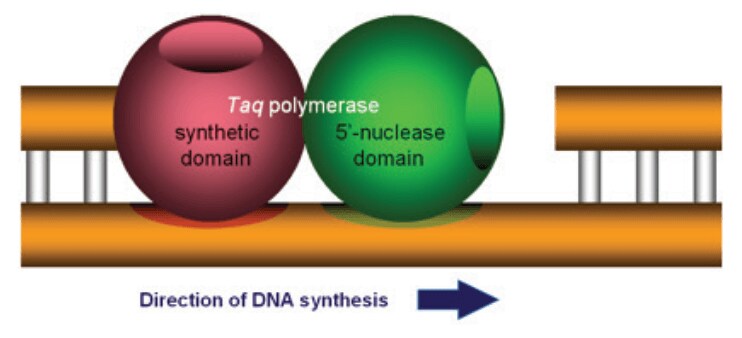
5′ヌクレアーゼアッセイは、Taq DNAポリメラーゼの持つ5′ヌクレアーゼ活性から命名されました(図2)。
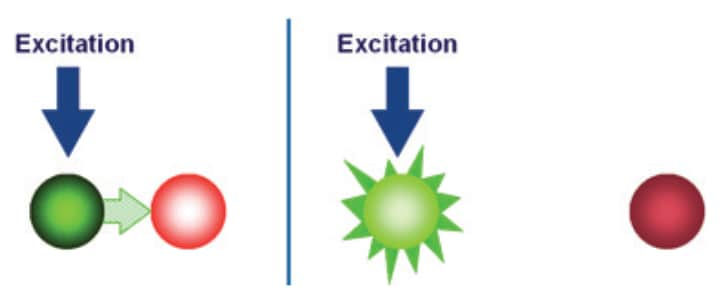
5′ヌクレアーゼドメインはDNA合成の下流に存在する、テンプレートに結合したDNAを分解することが可能です。5′ヌクレアーゼアッセイの第二の重要な要素はFRETと呼ばれる蛍光共鳴エネルギー移動現象です。FRETにおいて蛍光色素の発光は、近傍に存在するもう一つの色素、多くの場合クエンチャーと呼ばれる色素により、大きく低減されます(図3)。
FRETは、緑色と赤色の2つの蛍光色素によって説明できます。緑色の光は赤色の光より波長が短いため、緑色の蛍光色素は赤色と比較してより高い蛍光発光エネルギーを有しています。赤色色素が緑色色素の近傍に存在する場合、緑色の色素の励起により緑色の蛍光発光エネルギーが赤色の色素に移動します。言い換えると、エネルギーが高レベルから低レベルに移動します。結果として、緑色の色素からのシグナルは抑制、または「消光」されます。しかし、2つの色素が近接していない場合には、FRETは起こらず、緑色の色素は完全なシグナルを発します。
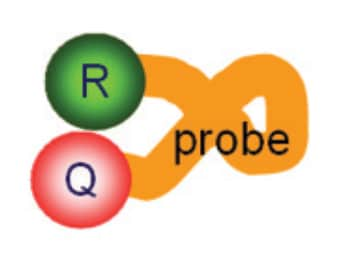
ターゲットの検出または定量のための典型的な5′ヌクレアーゼアッセイには、2つのPCRプライマーとTaqManプローブが含まれます(図4)。
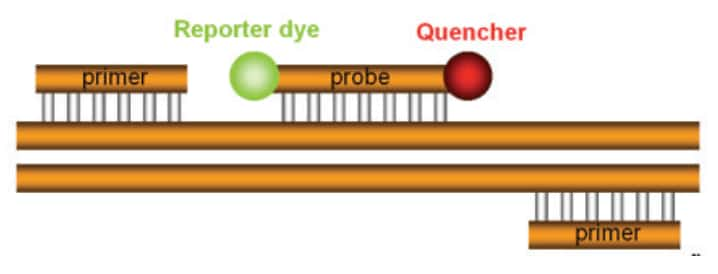
図4 TaqManプローブ。TaqManプローブは遺伝子特異的な配列を有し、2つのPCRプライマー間のターゲットに結合するようにデザインされています。TaqManプローブの5′末端にはターゲットの増幅をレポートする蛍光色素である、「レポーター」が結合しています。プローブの3′末端にはレポーターからの蛍光を消光するクエンチャーが結合しています。クエンチャーは、プローブの3′末端をブロックして熱安定性DNAポリメラーゼによる伸長を阻止する役目も果たしています。
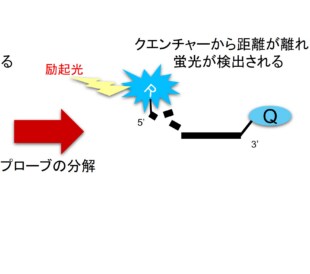
PCRの開始前においては、TaqManプローブは未変化で、レポーターとクエンチャーが近接しているためFRETを生じます(図5)。このため、レポーターのシグナルはPCR反応の前の段階では消光されています。
PCRの過程において、プライマーとプローブがターゲットにアニールします。DNAポリメラーゼがプライマーからプローブの上流まで伸長したとき、もしプローブが正しいターゲットに結合していれば、ポリメラーゼの5′ヌクレアーゼ活性によりプローブが切断され、レポーター色素を含んだ断片が放出されます。一度切断が起きるとレポーターとクエンチャーはもはやお互いに近接しなくなりますので、放出されたレポーター分子は消光されません。
5′ヌクレアーゼアッセイの特異性
アッセイの特異性とは、得られた結果においてアッセイがどの程度ターゲットからのシグナルを含み、非ターゲットからのシグナルを排除しているかを示します。特異性は、間違いなくアッセイの最も重要な要素です。5′ヌクレアーゼアッセイの特異性をおびやかす最大の要因となるのが相同配列です。相同配列は、ターゲットと類似した配列を有する遺伝子ですが目的とするターゲットではありません。相同配列は同種間および関連種間において極めてよく見られます。
5′ヌクレアーゼアッセイには、プライマーセットおよびプローブという2種類のツールを使用します。プライマーで最大限の特異性を確保するためには、ターゲットと相同配列の間のミスマッチがプライマーの3′末端塩基に位置していることが必要です。ミスマッチが3′末端から離れた位置にある場合は特異性にほとんど効果を発揮しません。これとは対照的に、Applied Biosystems™ TaqMan™ MGBプローブはどこにミスマッチが入っても高い特異性を確保できます。TaqMan MGBプローブはプライマーよりも強力な特異性に優れたツールです。
例えば、プライマー結合部位に1、2塩基のランダムミスマッチが存在していても、DNAポリメラーゼが相同配列に結合したプライマーから効率よく伸長する可能性は非常に高いです。ミスマッチプライマーからDNAポリメラーゼが1、2塩基伸長すると、相同配列に結合したプライマーが安定化されます。その結果、相同配列に結合したプライマーは、目的のターゲットに結合したプライマーと同等に安定して結合します。この時点では、もはやDNAポリメラーゼが相同配列のコピーを合成し続けるのを防ぐことは不可能です。
これとは対照的に、TaqManプローブ結合部位の5′末端におけるミスマッチは、3′末端にクエンチャー色素が存在するため、DNAポリメラーゼ反応により伸長および安定化される可能性はありません。TaqMan MGBプローブの結合部位にミスマッチが存在するとプローブの結合強度が低下するため、プローブは切断されずに遊離します。遊離したプローブは消光された状態のままですので、PCRサイクルの最後でデータを収集する時点においては、たとえ相同配列が増幅していても、得られるシグナルはターゲットから生成されたものであり相同配列に由来するものではありません。
相同配列に加えて、PCRにおいては、プライマーがDNA試料のランダムな部位に結合することにより生成する産物や、時にはプライマー同士が結合して生成するいわゆる「プライマーダイマー」などの非特異的産物が生成する可能性もあります。非特異的産物はターゲットと無関係であるためTaqManプローブ結合部位がなく、このためリアルタイムPCRデータには影響しません。
TaqManプローブのタイプ
TaqManプローブは、MGBおよび非MGBの2つのタイプに分類できます。初期のTaqManプローブは「非MGB」に分類されます。これらのプローブでは、クエンチャーとしてInvitrogen™ TAMRA™ 色素を使用しています。リアルタイムPCRの開発の初期の段階において、詳細な試験を行った結果、TaqManプローブを切断させるためにPCRプライマーよりも著しく高いアニーリング温度を必要とすることが判明しました。このため、TaqManプローブはプライマーよりも長くなっています。このように長いプローブに1塩基のミスマッチがあってもプローブ結合に対する影響が比較的小さいため、切断される可能性が高くなります。
しかし、真核生物における遺伝子発現や一塩基多型等の高度な遺伝的複雑性に関連する多くのアプリケーションにおいては、より高い特異性が必要です。その後TaqMan プローブ技術を改良することによりTaqMan MGBプローブが生まれました。TaqMan MGBプローブはその3′末端にマイナーグルーブ結合(MGB)分子を有しています。プローブがターゲットに結合する部分のDNAに短いマイナーグルーブが形成され、MGB分子が結合してTm が上昇することにより、プローブの結合が強化されます。結果として、TaqMan MGBプローブは、プライマーよりもかなり短くすることが可能です。MGBの存在により、TaqMan MGBプローブはTaqManプローブよりも短いにもかかわらずTm が高くなっています。このため、TaqMan MGBプローブはより高い温度において、プライマーよりも高い特異性をもってターゲットに結合することが可能となっています。TaqMan MGBプローブでは、プローブが比較的短いため1塩基のミスマッチがより大きな影響を与えます。この高い特異性のため、TaqMan MGBプローブは最も高度な遺伝子解析への使用が推奨されています。
TaqManプローブシグナル生成
TaqManプローブおよびTaqMan MGBプローブのいずれも、シグナル生成は同様のパターンを示します。PCRの初期のサイクルにおいては、低レベルの消光されたレポーターシグナルのみが検出されます。この初期データはリアルタイムPCRソフトウェアにおいては自動的にゼロに差し引かれ、「ベースライン」と呼ばれます。もし試料にターゲットが含まれていれば、十分な量の切断プローブが蓄積し、ベースラインを超える増幅シグナルが現れます。増幅シグナルが出現するポイントは、ターゲットの初期量に反比例しています。
SYBR Green色素
SYBR Green I 色素は、すべての二本鎖DNAのマイナーグルーブに結合する蛍光DNA結合色素です。DNAに結合したSYBR Green 色素が励起すると、非結合性の色素よりもはるかに強い蛍光シグナルを発生します。SYBR Green色素を使用するアッセイは通常2種類のPCRプライマーを用います。理想的な条件下では、SYBR Green色素アッセイは、TaqManプローブと同様の増幅パターンを示します。PCRの初期のサイクルにおいては水平なベースラインが観察されます。試料中にターゲットが存在すると、ある時点で十分な量のPCR産物が蓄積され、増幅シグナルが出現します。
SYBR Greenアッセイの特異性
SYBR GreenアッセイにおいてはTaqManプローブの特異性を利用することが不可能で、このため特異性がより大きな問題です。SYBR Green色素はターゲットまたは非ターゲットのすべての増幅産物に結合し、そのシグナルがすべて積算されて一つの増幅プロットが生成されます。SYBR Green 増幅プロットのパターンから特異性の評価をすることは不可能です。増幅がターゲット、非ターゲットまたはそれらの混合物からなる場合のいずれにおいても、プロットは同じパターンを示します。SYBR Greenアッセイにより増幅産物が生成しても、そのシグナルのほとんどがターゲット由来であるかどうかは不明です。
非ターゲットの増幅は試料ごとに大きく異なる可能性があるため、すべてのSYBR Green 反応に関して少なくとも1種類の特異性評価を行う必要があります。最も一般的には、解離解析が評価に使用されています。
SYBR Green解離解析
SYBR Green解離解析では、SYBR Greenを利用したPCR後にPCR産物を加熱して解離解析を行います。解離解析は追加費用が必要なく、PCR反応プレートを直接使用できるため、特異性評価において魅力ある選択肢です。しかし解離解析は、サーマルプロトコル時間を延長して行うため追加の解析時間が必要となり、主観的な面もあり、分離能が制限されています。
SYBR Green 解離解析は、ターゲットが一つの決まった遺伝子配列であるならば一つの特定の融点(Tm)を有し、それを利用して試料中のターゲットを同定することが可能というコンセプトに基づいています。非ターゲット産物の中にはターゲット産物とは著しく異なるTmを持つものがあり、そのような非ターゲットの増幅を検出することが可能です。
解離解析プロトコールはPCRサイクルの後に付け加えます。解離反応が終りしだい、リアルタイムPCRソフトウェアがデータを負の一次導関数としてプロットし、融解プロファイルをピークに転換します。
単一のターゲット分子を用いて増幅することで、ターゲットのピークを正確に同定できます。RNAおよびゲノムDNAなどの多くの試料は高度な遺伝子複雑性をもつため、ターゲットの増幅を抑制し、時には融解ピークの形状を変化させる可能性のある、非ターゲット増幅が起こる可能性を有しています。純粋なターゲットを同時に増幅すると、増幅後にTm のピークおよび形状を特定のターゲットと関連付けることができます。単独のピークのみが検出されるのが理想的です。ターゲットピークは、幅が狭く、対称的で、肩やピークが割れるなどの異常が観察されないことが必要です。これらの異常がみられた場合、近似するTmを有する複数の産物が存在する可能性が高く、これらの反応の特異性が強く疑われます。解離解析で異常がみられたウェルは解析対象外にする必要があります。
SYBR Green解離解析は分離能が低く、Tm が近似するターゲットと非ターゲット、例えば相同配列を識別することができない可能性があります。このため、さらに根拠となる情報がない場合には、1つの幅の狭い対称的なピークをターゲット由来のピークであると完全にみなすことはできません。
解離解析データは、増幅が観察されたすべてのウェルにおいてそれぞれ評価する必要があります。試料に純粋なターゲットピークに相当しないピークが存在する場合には、その反応においてターゲットは検出されていないと判断します。試料に単一のターゲットピークのTm および形状とマッチするピークが含まれる場合には、その反応においてターゲットが増幅された可能性があります。解離解析データは、それのみでは決定的要素となりませんが、ターゲットを含まない試料からのデータ、シーケンシング、またはゲル電気泳動など他のデータと組み合わせることによって、特異性の信頼度を高めることができます。
リアルタイムPCR装置
様々な仕様のリアルタイムPCR装置がありますが、全ての装置に蛍光色素を励起する励起光源および蛍光発光を検出する検出器およびサーマルサイクラーが搭載されています。サーマルブロックには、Applied Biosystems™ StepOnePlus™ システムに搭載されている固定型と、Applied Biosystems™ ViiA™ 7 システムおよびAppliedBiosystems™ QuantStudio™ 12K Flex システムに搭載されているようなユーザーが交換可能なタイプがあります。48ウェルプレート、96ウェルプレート、384ウェルプレート、384マイクロウェルカード、3072スルーホールプレートなど様々なPCR反応フォーマットが使用できるリアルタイムPCR装置をご提供しています。又すべてのリアルタイムPCR装置にはデータ収集および解析用のソフトウェアが搭載されています。
色素の識別
通常リアルタイムPCR反応系には複数の色素が含まれています。例を挙げると、1つ又は複数のリポーター色素、クエンチャー色素、そして最も頻繁に使用されるパッシブリファレンス色素などです。同一ウェルに複数の蛍光が入っている場合も、励起および発光フィルターの最適な組み合わせおよびマルチコンポーネント補正により、個別に測定することが可能です。
マルチコンポーネント補正は反応中の各色素の蛍光強度を測定する手法です。マルチコンポーネンティングは、検出された蛍光シグナルの構成要素を分離、区別するアルゴリズムです。このシステムを用いたソフトウエアにより、蛍光色素のシグナルを正確に解析し、複数の蛍光色素の同時検出が可能になり、又、トラブルシューティングに有用な情報も得られます。
【無料ダウンロード】リアルタイムPCRハンドブック
このハンドブックでは、リアルタイムPCRの理論や実験デザインの設計など、リアルタイムPCRの基礎知識が掲載されています。リアルタイムPCRを始めたばかりの方やこれから実験を考えている方にうってつけのハンドブックです。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
【無料公開中】リアルタイムPCRトラブルシューティング
異常なS字状の増幅曲線、NTCでの増幅検出、増幅が見られないなど、リアルタイムPCRの実験中に困った際の手助けになる情報を紹介しています。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申し込みください。
研究用にのみ使用できます。診断用には使用いただけません。